题目内容
【题目】下列实验装置,其中按要求设计正确的是
A. 电解饱和食盐水并验证产物 | B. 铜锌原电池电流方向如图所示 |
C. 在钥匙上电镀银 | D. 电解精炼铜 |
A. A B. B C. C D. D
【答案】B
【解析】
A.电解饱和的氯化钠溶液时,活泼电极作阳极,则阳极上放电的是阳极材料而不是溶液中阴离子;
B.含有盐桥的原电池中,电极材料和相应的电解质溶液有相同的金属元素;
C.电镀时,电解质溶液中的金属元素要和镀层相同;
D.电解精炼铜时,粗铜作阳极,纯铜作阴极,且电解质溶液中必须含有铜离子。
A.该电解池中,阳极上铁失电子而不是氯离子失电子,所以阳极上得不到氯气,则淀粉碘化钾溶液不会变蓝,所以实验设计不合适,故A错误;
B.含有盐桥的铜锌原电池中,铜电极对应的电解质是铜盐,锌电极对应的电解质是锌盐,符合原电池设计要求,所以B选项是正确的;
C.该电镀池中电解质应该是硝酸银而不是硝酸钠,故C错误;
D.电解精炼铜时,粗铜作阳极,纯铜作阴极,故D错误。
所以B选项是正确的。

【题目】研究氮及其化合物的性质在人类进步过程中具有极为重要的意义。
(1)肼(N2H4)与N2O4分别是火箭发射中最常用的燃料与氧化剂。已知2N2H4(l)+N2O4(l)===3N2(g)+4H2O(l) ΔH=-1 225 kJ·mol-1。几种化学键的键能数据如下:
化学键 | N—H | N—N | N≡N | O—H |
键能/(kJ·mol-1) | 390 | 190 | 946 | 460 |
则1 mol N2O4(l)完全分解成相应的原子时需要吸收的能量是________。
(2)N2O4与NO2转化的热化学方程式为N2O4(g)![]() 2NO2(g) ΔH=+24.4 kJ·mol-1。
2NO2(g) ΔH=+24.4 kJ·mol-1。
①将一定量的N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是________(填字母)。
a.v正(N2O4)=2v逆(NO2) b.体系颜色不变
c.气体平均相对分子质量不变 d.气体密度不变
②在一密闭容器中发生该反应,达到平衡后,保持体积不变升高温度,再次达到平衡时,则混合气体的颜色________(填“变深”“变浅”或“不变”),判断理由______________________________________。
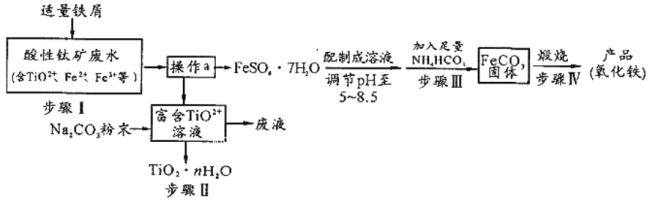
③平衡常数K可用反应体系中气体物质平衡分压表示,即K表达式中平衡浓度可用平衡分压代替,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数K的表达式________(用p总、各气体物质的量分数x表示);影响K的因素为________。
(3)氨是一种重要的化工原料,在工农业生产中有广泛的应用。在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中,限着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间(t)的关系如表所示:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2/span>)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
①该温度下,若向同容积的另一容器中投入N2、H2、NH3,其浓度均为3 mol·L-1,则此时v正________________(填“大于”“小于”或“等于”)。
②由表中的实验数据可得到“c—t”的关系,如图1所示,表示c(N2)—t的曲线是________。在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)—t的曲线上相应的点为________。
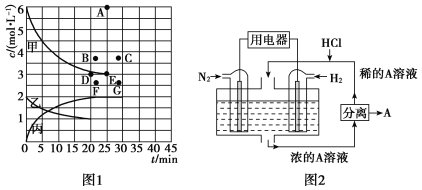
(4)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图2所示。电池正极的电极反应式是____________________,A是_______________________________。