题目内容
【题目】研究氮及其化合物的性质在人类进步过程中具有极为重要的意义。
(1)肼(N2H4)与N2O4分别是火箭发射中最常用的燃料与氧化剂。已知2N2H4(l)+N2O4(l)===3N2(g)+4H2O(l) ΔH=-1 225 kJ·mol-1。几种化学键的键能数据如下:
化学键 | N—H | N—N | N≡N | O—H |
键能/(kJ·mol-1) | 390 | 190 | 946 | 460 |
则1 mol N2O4(l)完全分解成相应的原子时需要吸收的能量是________。
(2)N2O4与NO2转化的热化学方程式为N2O4(g)![]() 2NO2(g) ΔH=+24.4 kJ·mol-1。
2NO2(g) ΔH=+24.4 kJ·mol-1。
①将一定量的N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是________(填字母)。
a.v正(N2O4)=2v逆(NO2) b.体系颜色不变
c.气体平均相对分子质量不变 d.气体密度不变
②在一密闭容器中发生该反应,达到平衡后,保持体积不变升高温度,再次达到平衡时,则混合气体的颜色________(填“变深”“变浅”或“不变”),判断理由______________________________________。
③平衡常数K可用反应体系中气体物质平衡分压表示,即K表达式中平衡浓度可用平衡分压代替,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数K的表达式________(用p总、各气体物质的量分数x表示);影响K的因素为________。
(3)氨是一种重要的化工原料,在工农业生产中有广泛的应用。在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中,限着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间(t)的关系如表所示:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2/span>)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
①该温度下,若向同容积的另一容器中投入N2、H2、NH3,其浓度均为3 mol·L-1,则此时v正________________(填“大于”“小于”或“等于”)。
②由表中的实验数据可得到“c—t”的关系,如图1所示,表示c(N2)—t的曲线是________。在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)—t的曲线上相应的点为________。
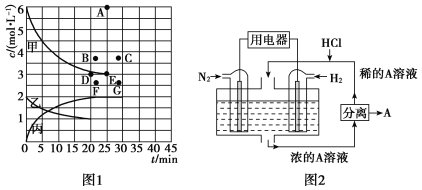
(4)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图2所示。电池正极的电极反应式是____________________,A是_______________________________。
【答案】1793 kJ bc 变深 正反应是吸热反应,其他条件不变,温度升高平衡正向移动,c(NO2)增大,气体颜色加深 K=p总·x2(NO2)/x(N2O4) 温度 大于 乙 B N2+8H++6e-===2NH4+ 氯化铵(或NH4Cl)
【解析】
(1)N2O4(l)完全分解成相应的原子需要断裂分子中所有的化学键,故需要的总能量就等于其中化学键的总键能,设1 mol N2O4(l)的总键能为E,则ΔH=反应物的总键能-生成物的总键能,带入数据进行计算;
(2) ①化学平衡状态的判定依据:正逆反应速率相等,各组分浓度保持不变以及由此衍生出的其他物理量的变化情况进行分析;
②该反应是吸热反应,升高温度,平衡正向移动,据此进行分析。
③影响平衡常数的因素只有温度,根据K=![]() 表达式,将c(NO2)、c(N2O4)换成p(NO2)、p(N2O4)即可。
表达式,将c(NO2)、c(N2O4)换成p(NO2)、p(N2O4)即可。
(3)①先求出该温度下的化学平衡常数K,然后根据题给条件下求出Qc,根据Qc与K的关系判断反应进行的情况,以此判断v正与v逆大小关系;
②氮气是反应物,不断被消耗,其消耗量是氢气的消耗量1/3倍,根据图象中曲线变化进行判定c(N2)—t的曲线;起始充入4 molN2和12 mol H2,相当于将充入2.00 mol N2和6.00 mol H2的两个容器“压缩”为一个容器,假设平衡不移动,则平衡时c(H2)=6mol·L-1,而“压缩”后压强增大,据此分析反应速率、平衡移动情况,得出结论。
(4)氮气在正极上发生还原反应生成铵根离子,A是氯化铵,据此书写极反应方程式。
(1)N2O4(l)完全分解成相应的原子需要断裂分子中所有的化学键,故需要的总能量就等于其中化学键的总键能,设1 mol N2O4(l)的总键能为E,则ΔH=反应物的总键能-生成物的总键能=(8×390 kJ·mol-1+2×190 kJ·mol-1+E)-(3×946 kJ·mol-1+8×460 kJ·mol-1)=-1 225 kJ·mol-1,则E=1793 kJ·mol-1,即1 mol N2O4(l)完全分解成相应的原子时需要吸收的能量是1793 kJ,
综上所述,本题答案是:1793 kJ 。
(2)①a.达到化学平衡的条件是正逆反应速率相等,即v(正)(N2O4)/ v(逆)(NO2)=1/2,得2v正(N2O4)=v逆(NO2),所以a错误。
b.N2O4为无色,NO2为红棕色,若颜色不变,说明c(NO2)及c(N2O4)不变,即各物质的浓度不变,所以b正确。
c.![]() ,均是气体,m(气)不变,但在反应过程中气体的总物质的量发生变化,其平均相对分子质量也在变化,若气体平均相对分子质量不变,说明n(气)不变,则各物质的物质的量浓度不变,达到化学平衡状态,所以c正确。
,均是气体,m(气)不变,但在反应过程中气体的总物质的量发生变化,其平均相对分子质量也在变化,若气体平均相对分子质量不变,说明n(气)不变,则各物质的物质的量浓度不变,达到化学平衡状态,所以c正确。
d.气体的质量不变,容器体积不变,在反应过程中,密度始终不变,所以气体密度不变不能说明反应达到平衡状态,d错误。
综上所述,本题选bc。
②该反应是吸热反应,升高温度,平衡正向移动,c(NO2)增大,颜色加深。
综上所述,本题答案是:变深;正反应是吸热反应,其他条件不变,温度升高平衡正向移动,c(NO2)增大,气体颜色加深。
③根据K=![]() 表达式,将c(NO2)、c(N2O4)换成p(NO2)、p(N2O4),平衡常数表达式为:K=p总·x2(NO2)/x(N2O4);影响平衡常数的因素只有温度。
表达式,将c(NO2)、c(N2O4)换成p(NO2)、p(N2O4),平衡常数表达式为:K=p总·x2(NO2)/x(N2O4);影响平衡常数的因素只有温度。
综上所述,本题答案是:K=p总·x2(NO2)/x(N2O4);温度。
(3)①该温度下,25 min时反应处于平衡状态,平衡时c(N2)=1 mol·L-1、c(H2)=3 mol·L-1、c(NH3)=2 mol·L-1,则K= c2(NH3)/c3(H2)c(N2),带入数值计算结果为:K=4/27 L2·mol-2;在该温度下,若向同容积的另一容器中投入N2、H2和NH3,其浓度均为3 mol·L-1,则Qc= c2(NH3)/c3(H2)c(N2),带入数值计算结果为:Qc=1/9L2·mol-2<K,反应正向进行,故
综上所述,本题答案是:大于。
②氮气是反应物,不断被消耗,根据图表可知,氢气的消耗量是氮气的3倍,甲为氢气的浓度变化曲线,因此表示c(N2)—t的曲线是乙。起始充入4 mol N2和12 mol H2,相当于将充入2.00 mol N2和6.00 mol H2的两个容器“压缩”为一个容器,假设平衡不移动,则平衡时c(H2)=6 mol·L-1,而“压缩”后压强增大,反应速率加快,平衡正向移动,故平衡时3 mol·L-1<c(H2)<6 mol·L-1,且达到平衡的时间缩短,故对应的点为B。
综上所述,本题答案是:乙,B。
(4)酸性环境下,氮气在正极上发生还原反应生成铵根离子,电极反应为:N2+8H++6e-=2NH4+ ,A是氯化铵(或NH4Cl)。
综上所述,本题答案是:N2+8H++6e-=2NH4+ ;氯化铵(或NH4Cl)。

 天天练口算系列答案
天天练口算系列答案