题目内容
已知:化学反应3Ag+ 4HNO3 (稀)= 3AgNO3+ NO↑+ 2H2O
(1)该反应的离子方程式为:_________________________________ ____
(2)当有32.4克银溶解时,反应生成的NO在标况下的体积是多少?
(3)当有0.2mol银溶解时,有多少克HNO3被还原?
(1)该反应的离子方程式为:_________________________________ ____
(2)当有32.4克银溶解时,反应生成的NO在标况下的体积是多少?
(3)当有0.2mol银溶解时,有多少克HNO3被还原?
(1)3Ag+4H++NO3-=3Ag++NO↑+2H2O
(2)2.24L (3)4.2g
(2)2.24L (3)4.2g
考查根据方程式进行的有关计算。
(1)根据化学方程式可知,该反应的离子方程式为3Ag+4H++NO3-=3Ag++NO↑+2H2O。
(2)32.4g银是324g÷108g.mol=0.3mol,所以根据方程式可知生成NO是0.1mol,标准状况下的体积是2.24L。
(3)0.2mol银失去0.2mol电子。稀释在反应中得到3个电子,所以被还原的硝酸是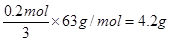 。
。
(1)根据化学方程式可知,该反应的离子方程式为3Ag+4H++NO3-=3Ag++NO↑+2H2O。
(2)32.4g银是324g÷108g.mol=0.3mol,所以根据方程式可知生成NO是0.1mol,标准状况下的体积是2.24L。
(3)0.2mol银失去0.2mol电子。稀释在反应中得到3个电子,所以被还原的硝酸是
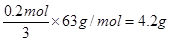 。
。
练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
 2SO3,在一密闭容器中一定时间内达到平衡.
2SO3,在一密闭容器中一定时间内达到平衡.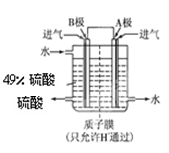
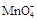 + —— Fe3++ Mn2++
+ —— Fe3++ Mn2++