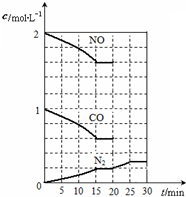
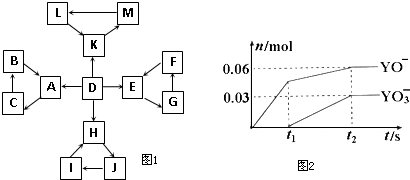
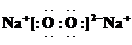题目内容
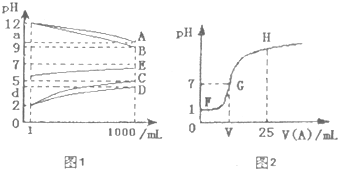
常温下将一定浓度的一元酸HA和0.1 mol·L-1NaOH溶液等体积混合后,下列说法正确的是
- A.若pH=7,HA的浓度一定为0.1 mol·L-1
- B.若pH>7,HA的pH不可能等于1
- C.若pH<7,溶液中的微粒浓度关系为: c(Na+)=c(HA)+c(A-)
- D.若pH=12,且HA为强酸时,HA的浓度应为0.08 mol·L-1
BD
试题分析:问题集中在酸是强酸还是弱酸,如果是强酸,一元强酸和一元强碱等体积、等浓度混合,混合后溶液呈中性,但如果为一元弱酸,等体积、等浓度混合,恰好生成强碱弱酸盐,溶液是呈现碱性的,所以如果溶液呈现中性,酸的体积要大一点,A项错;如果酸非常的多,就不存在C项的关系,C项错。
考点:考查离子浓度大小比较、溶液PH值、盐类水解等,难度中等,判断一元酸HA是弱酸为解题关键.
试题分析:问题集中在酸是强酸还是弱酸,如果是强酸,一元强酸和一元强碱等体积、等浓度混合,混合后溶液呈中性,但如果为一元弱酸,等体积、等浓度混合,恰好生成强碱弱酸盐,溶液是呈现碱性的,所以如果溶液呈现中性,酸的体积要大一点,A项错;如果酸非常的多,就不存在C项的关系,C项错。
考点:考查离子浓度大小比较、溶液PH值、盐类水解等,难度中等,判断一元酸HA是弱酸为解题关键.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目