题目内容
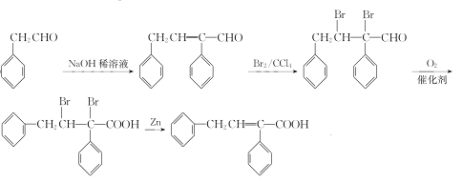
【题目】高分子树脂具有较好的吸水性,其合成线路如下:

已知:I:-CHO+-CH2CHO![]() -CH=CHCHO
-CH=CHCHO
II. -CH=CH-COOH
-CH=CH-COOH
回答下列问题
(1)G中的含氧官能团名称为______,M的结构简式为_______。
(2)由A生成B的化学方程式为______________________。
(3)上述合成路线中,D→E的转化在合成M中的作用为_________________。
(4)下列选项中对有机物F的性质推测正确的是_______________________。(填字母)
A. 1mol F与足量NaHCO3溶液反应放出2molCO2
B. 能发生水解反应和消去反应
C. 能聚合成高分子化合物
D. 1 mol F最多消耗3 mol NaOH
(5)符合下列条件的G的同分异构体有________种
A.属于芳香族化合物,且只有1种官能团
B.能发生银镜反应
C.除苯环外不存在其他环状结构
其中核磁共振氢谐有4组峰的是________(写出其中一种的结构简式)
(6)根据上述合成路线和信息,以苯乙醛为原料(其他无机试剂任选)设计制备 的合成路线______
的合成路线______
【答案】羧基 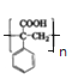
![]() 保护碳碳双键,防止其被氧化 BD 10
保护碳碳双键,防止其被氧化 BD 10 
【解析】
![]() 与Cl2在光照条件下生成的A为
与Cl2在光照条件下生成的A为![]() ,再在NaOH的水溶液中加热水解生成的B为
,再在NaOH的水溶液中加热水解生成的B为![]() ,再催化氧化得到的C为
,再催化氧化得到的C为![]() ,C和HCHO在NaOH的稀溶液中反应生成的D为
,C和HCHO在NaOH的稀溶液中反应生成的D为![]() ,D再与Br2发生加成反应生成的E为
,D再与Br2发生加成反应生成的E为![]() ,E催化氧化后得到的F为
,E催化氧化后得到的F为![]() ,F在Zn粉的作用下发生消去反应生成的G为
,F在Zn粉的作用下发生消去反应生成的G为![]() ,G再发生加聚反应得到M为
,G再发生加聚反应得到M为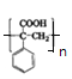 ;
;
(1)通过上述分析,G为![]() ,含氧官能团是羧基。G再发生加聚反应得到M为
,含氧官能团是羧基。G再发生加聚反应得到M为 ,故答案为:羧基;
,故答案为:羧基; ;
;
(2)A为![]() ,在NaOH的水溶液中加热水解生成的B为
,在NaOH的水溶液中加热水解生成的B为![]() ,反应的方程式为:
,反应的方程式为:![]()
(3)D![]() 与Br2发生加成反应生成的E
与Br2发生加成反应生成的E![]() ,F在Zn粉的作用下发生消去反应生成
,F在Zn粉的作用下发生消去反应生成![]() 重新得到碳碳双键,所以D→E是为了保护碳碳双键,故答案为:保护碳碳双键,防止其被氧化;
重新得到碳碳双键,所以D→E是为了保护碳碳双键,故答案为:保护碳碳双键,防止其被氧化;
(4)A. 1mol![]() 与足量NaHCO3放出1molCO2,A错误;
与足量NaHCO3放出1molCO2,A错误;
B.溴原子在氢氧化钠的水溶液中可以水解,也可以在氢氧化钠的醇溶液发生消去反应,B正确;
C.![]() 没有碳碳双键,也没有碳碳三键,不能聚合成高分子化合物,C错误;
没有碳碳双键,也没有碳碳三键,不能聚合成高分子化合物,C错误;
D.羧基消耗1mol NaOH,两个溴原子消耗2mol NaOH,共消耗3mol NaOH,D正确;
选BD。
(5)![]() ,侧链不饱和度为2,属于芳香族化合物,且只有1种官能团,而且要发生银镜反应,除苯环外不存在其他环状结构,说明必须有两个醛基,若苯环上有两个-CHO,一个-CH3,就有6种同分异构体;若苯环上是一个-CHO,一个-CH2CHO,就有邻间对三种同分异构体;若苯环上是一个-CH(CHO)CHO,就有一种结构;共有10种同分异构体。其中核磁共振氢谐有4组峰的是
,侧链不饱和度为2,属于芳香族化合物,且只有1种官能团,而且要发生银镜反应,除苯环外不存在其他环状结构,说明必须有两个醛基,若苯环上有两个-CHO,一个-CH3,就有6种同分异构体;若苯环上是一个-CHO,一个-CH2CHO,就有邻间对三种同分异构体;若苯环上是一个-CH(CHO)CHO,就有一种结构;共有10种同分异构体。其中核磁共振氢谐有4组峰的是 。故答案为:10;
。故答案为:10; ;
;
(6)以苯乙醛为原料合成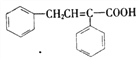 的合路线为:
的合路线为:
 。
。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案【题目】研究化学反应时,既要考虑物质变化与能量变化,又要关注反应的快慢与限度。回答下列问题:
(1)NH3还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图所示

①上图中因为改变了反应条件,反应的活化能:b_______(填“>”“<"或“=”)a。
②脱硝反应的热化学方程式可表示为反应物→生成物△H=______(用E1、E2的代数式表示)。
③研究发现,一定条件下的脱硝反应过程可能如图所示,根据氧化还原反应中物质的作用,NO为_______剂,脱硝总反应的化学方程式为_______________。

(2)一定温度下,将不同物质的量的H2O(g)和CO分别通入容积为1L的恒容密容器中,进行反应H2O(g)+CO(g)![]() CO2(g)+H2(g),得到如表所示的三组数据
CO2(g)+H2(g),得到如表所示的三组数据
试验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡时间/min | ||
H2O(g) | CO(g) | CO(g) | H2(g) | |||
1 | 650 | 2.0 | 4.0 | 3.0 | 1.0 | 5 |
2 | 900 | 1.0 | 2.0 | 1.8 | 0.2 | 4 |
3 | 900 | a | b | c | d | t |
①4mim内,实验2中v(CO2)=______; 900℃时,反应的平衡常数为______;降低温度时,平衡常数会________(填“增大”“减小”或“不变”)。
②650℃时,若在此容器中充入2.0 mol H2O(g)、1.0molCO(g)、1.0 mol CO2(g)和 xmol H2(g),要使反应在开始时向正反应方向进行,则x应满足的条件是__________。
若a=2.0.b=1.0,则平衡时实验2中H2O(g)和实验3中CO(g)的转化率(a)的关系为a(H2O) _______ (填“>”<”成=”)a(CO)。
【题目】为验证氧化性Cl2 > Fe3+> SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略)。

实验过程:
Ⅰ.查好装置的气密性后,在各仪器中添加相应试剂
Ⅱ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4
Ⅲ.打开活塞a,滴加一定量的浓盐酸,给A加热
Ⅳ.当B中溶液变黄时,停止加热,关闭K2
Ⅴ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅵ.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3
VII. 更换试管D,重复过程V,检验B溶液中的离子
(1)检验虚线框内装置气密性的操作是____。
(2)B棉花中浸润的溶液为____。实验Ⅱ通入N2的作用是____。
(3)C中发生反应的化学方程式_____。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是____。
(5)若将制取的SO2通入酸性高锰酸钾溶液可使溶液褪色,其离子方程式为___。
(6)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性Cl2 > Fe3+>SO2的是___(填“甲”“乙”“丙”)。
过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
甲 | 既有Fe3+又有Fe2+ | 有SO42- |
乙 | 有Fe3+无Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |





