题目内容
【题目】下列转化过程中,氮元素化合价升高的是( )
A.雷雨条件下大气中的N2转变为HNO3
B.高温高压和Fe催化条件下工业合成NH3
C.蓝藻等原核生物将N2转变为铵盐
D.化肥NH4HCO3在使用中分解为NH3
【答案】A
【解析】
A. 雷雨条件下大气中的N2转变为NO、NO2,最后生成HNO3,氮元素化合价升高,A符合题意;
B. 高温高压和Fe催化条件下,工业上由氮气和氢气合成NH3,氮元素化合价降低,B不符合题意;
C. 蓝藻等原核生物将N2转变为铵盐,氮元素化合价降低,C不符合题意;
D. 化肥NH4HCO3在使用中分解为NH3,氮元素化合价不变,D不符合题意;
答案选A。

【题目】某科研小组用镍触媒废料(主要成分为Ni-Al合金,混有少量Fe、Cu、Zn及有机物) 制备NiO并回收金属资源的流程如下所示:
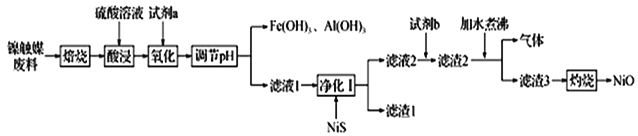
已知:相关数据如表1和表2所示
表1部分难溶电解质的溶度积常数(25℃)
物质 | Ksp | 物质 | Ksp |
Fe(OH)3 | 4.0×10-38 | CuS | 6.3×10-34 |
Fe(OH)2 | 1.8×10-16 | ZnS | 1.6×10-24 |
Al(OH)3 | 1.0×10-33 | NiS | 3.2×10-18 |
Ni(OH)2 | 2.0×10-15 |
表2 原料价格表
物质 | 价格/(元吨-1) |
漂液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
请回答下列问题:
(1)“焙烧”的目的是________________________________。
(2)“试剂a”的名称为__________________;选择该试剂的理由是______。
(3)“氧化”时反应的离子方程式为__________________________________________。
(4)欲使溶液中Fe3+和A13+的浓度均小于等于1.0×10-6 mol L-1,需“调节pH”至少为_______________。
(5)“试剂b”应选择__________,“加水煮沸”时,反应的化学方程式为_______________________________。
(6)氢镍电池是一种应用广泛的二次电池,放电时,该电池的总反应为NiOOH+MH=Ni(OH)2+M,当导线中流过2 mol电子时,理论上负极质量减少__________g。充电时的阳极反应式为_______________________________________________。