题目内容
【题目】硫代硫酸钠晶体(Na2S2O35H2O)俗名“大苏打”,又称“海波”.已知Na2S2O35H2O是无色透明晶体,易溶于水,不溶于乙醇.它受热、遇酸易分解,在空气中易被氧化.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O35H2O).反应原理为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2 . 
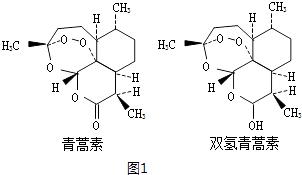
(1)(图1)制备Na2S2O3
①仪器b的名称 , d中盛放的试剂是 .
②b中制备SO2 , 反应的化学方程式 .
③反应开始后,要控制SO2生成速率,可以采取的措施有(写出一条即可).
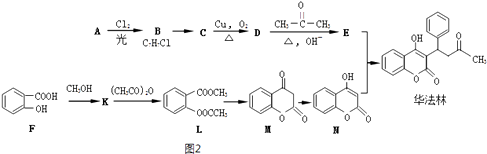
(2)分离Na2S2O3并测定含量(图2)
(I)为了减少产品损失,操作①时需 . 操作②是过滤、洗涤、干燥,其中洗涤操作时用做洗涤剂.干燥操作时(装置如图3所示),通入H2的目的是 .
(II)制得的粗晶体中往往含有少量杂质.为了测定粗产品中Na2S2O35H2O的含量,采用在酸性条件下用KMnO4标准液滴定的方法(假设粗产品中的杂质与酸性KMnO4溶液不反应).称取1.50g粗产品溶于水,用0.20molL﹣1KMnO4溶液(加适量稀硫酸酸化)滴定,当溶液中S2O32﹣全部被氧化时,消耗高锰酸钾溶液体积40.00mL.(5S2O32﹣+8MnO4﹣+14H+═8Mn2++10SO42﹣+7H2O)
①KMnO4溶液置于(填“酸式”或“碱式”)滴定管中.
②若 , 则达到滴定终点.
③产品中Na2S2O35H2O的质量分数为(保留小数点后一位).
【答案】
(1)蒸馏烧瓶;氢氧化钠溶液;Na2SO3+H2SO4(浓) ![]() ?Na2SO4+SO2↑+H2O;控制反应温度或调节酸的滴加速度等
?Na2SO4+SO2↑+H2O;控制反应温度或调节酸的滴加速度等
(2)趁热过滤;乙醇;排出空气,防止硫代硫酸钠被氧化;酸式;滴入最后一滴高锰酸钾标准液后,溶液恰好由无色变浅紫红色,且半分钟不褪色;82.7%
【解析】解:(1)①由仪器结构可知,仪器b为蒸馏烧瓶;蒸馏烧瓶中浓硫酸与亚硫酸钠反应制备SO2 , c装置中制备Na2S2O3 , d装置吸收多余的二氧化硫,防止污染空气,应用氢氧化钠溶液吸收,所以答案是:蒸馏烧瓶;氢氧化钠溶液;
②b中制备SO2 , 浓硫酸与亚硫酸钠反应生成硫酸钠、二氧化硫与水,反应方程式为:Na2SO3+H2SO4(浓) ![]() Na2SO4+SO2↑+H2O,
Na2SO4+SO2↑+H2O,
所以答案是:Na2SO3+H2SO4(浓) ![]() Na2SO4+SO2↑+H2O;
Na2SO4+SO2↑+H2O;
③反应开始后,要控制SO2生成速率,可以采取的措施有:控制反应温度或调节酸的滴加速度等,
所以答案是:控制反应温度或调节酸的滴加速度等;
控制SO2生成速率;(2)(I)需要趁热过滤,防止硫代硫酸钠晶体析出;
硫酸硫酸钠易溶于水,不溶于乙醇,为减少溶解单质的损失,应用乙醇洗涤;
用氢气排出空气,防止硫代硫酸钠被氧化,
所以答案是:趁热过滤;乙醇;排出空气,防止硫代硫酸钠被氧化;(II)①KMnO4溶液具有强氧化性,可以腐蚀橡皮管,应盛放在酸式滴定管中,
所以答案是:酸式;
②Na2S2O3反应完毕,滴入最后一滴高锰酸钾标准液后,溶液恰好由无色变浅紫红色,且半分钟不褪色,说明反应到达终点,
所以答案是:滴入最后一滴高锰酸钾标准液后,溶液恰好由无色变浅紫红色,且半分钟不褪色;
③由方程式可知n(Na2S2O35H2O)=n(S2O32﹣)= ![]() n(KMnO4)=
n(KMnO4)= ![]() ×0.04L×0.2mol/L=0.005mol,则m(Na2S2O35H2O)=0.005mol×248g/mol=1.24g,则Na2S2O35H2O在产品中的质量分数为
×0.04L×0.2mol/L=0.005mol,则m(Na2S2O35H2O)=0.005mol×248g/mol=1.24g,则Na2S2O35H2O在产品中的质量分数为 ![]() ×100%=82.7%,
×100%=82.7%,
所以答案是:82.7%.