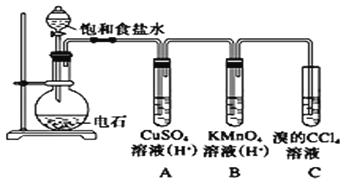
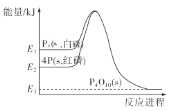
题目内容
【题目】氮的重要化合物如氨(NH3)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1) 利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g) △H1=44.0 kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2=229.3 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-906.5 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H4
则△H4=_______kJ·mol-1。
(2)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
① 写出该反应的离子方程式:________。
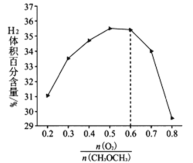
② 在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为:________;为抑制肼的分解,可采取的合理措施有________(任写一种)。
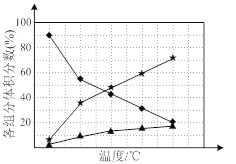
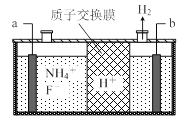
图1 图2
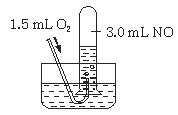
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。
① 氮化硅的化学式为___________________。
② a电极为电解池的_____________(填“阴”或“阳”)极,写出该电极的电极反应式:________________;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是_______________。
【答案】-2317.0 Co2++N2H4+4OH-=2Co↓+N2↑+4H2O 3N2H4![]() N2+4NH3 降低温度 Si3N4 阳 NH4++3F--6e-=NF3+4H+ F2
N2+4NH3 降低温度 Si3N4 阳 NH4++3F--6e-=NF3+4H+ F2
【解析】
(1)根据盖斯定律分析,反应③-②×5-①×6得热化学方程式为4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H4=-906.5-(229.3×5)-(44×6)= -2317.0kJ/mol。
(2)①根据题意,钴元素的化合价降低,所以氮元素化合价升高,只能为0价,即为氮气,据此分析还有水生成,根据得失电子守恒和原子守恒配平方程式为Co2++N2H4+4OH-=2Co↓+N2↑+4H2O
②使湿润的红色石蕊试纸变蓝的气体为氨气,即肼分解生成氨气,依据元素守恒可知,另外一种产物为氮气,所以方程式为3N2H4![]() N2+4NH3;从图分析,温度越高,肼的体积分数含量越低,所以要抑制肼的分解,应降低温度。
N2+4NH3;从图分析,温度越高,肼的体积分数含量越低,所以要抑制肼的分解,应降低温度。
(3)①氮化硅中氮的非金属性强于硅,硅显+4价,氮显-3价,所以氮化硅的化学式为Si3N4
②由图2可知,氢离子在b极上得到电子生成氢气,所以b为阴极,a为阳极。阳极铵根离子失去电子生成三氟化氮,电极反应为 NH4++3F--6e-=NF3+4H+;依据电解原理可知,氟离子也可能失去电子生成氟单质,所以氧化性较强的单质为氟气。