题目内容
【题目】在进行锌铜双液原电池实验时,若用铜丝代替盐桥(如图),外电路中仍然存在较小的电流,随着时间 的推移,电流逐渐减小。下列关于该装置说法错误的是
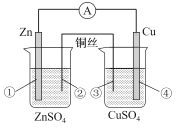
A.左池形成了原电池,Zn极的电势最高
B.铜丝②附近溶液的pH将升高
C.右池为电解池,铜丝③的反应式为 Cu-2eˉ=Cu2+
D.铜片④上有新的亮红色固体附着
【答案】A
【解析】
根据电化学原理可知,左池能自发的发生氧化还原反应,是原电池,锌作负极失电子生成Zn2+,铜丝②作正极,空气中的O2得电子:O2+4e-+2H2O=4OH-;右池是电解池,③是阳极,铜失电子生成Cu2+,铜片④是阴极,Cu2+得电子生成Cu。据此分析。
A.根据电化学原理可知,左池是原电池,锌作负极,铜作正极,故铜丝②极电势高于锌极,A错误;
B.铜丝②作正极,空气中的O2得电子:O2+4e-+2H2O=4OH-,故附近的pH将升高,B正确;
C.右池是电解池,③是阳极,铜失电子生成Cu2+,反应式为 Cu-2e-=Cu2+,C正确;
D.铜片④是阴极,Cu2+得电子生成Cu,有新的亮红色固体附着,D正确;
答案选A。

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目