题目内容
【题目】在恒温恒容容器中发生反应2SO2(g)+O2(g)![]() 2SO3(g),起始时SO2和O2分别为20 mol和10 mol,达到平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为( )
2SO3(g),起始时SO2和O2分别为20 mol和10 mol,达到平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为( )
A. 10mol和10%B. 20mol和20%C. 20mol和40%D. 30mol和80%
【答案】B
【解析】
从等效平衡的角度进行分析;
达到平衡时,各成分的体积分数与前者相同,说明这两个平衡互为等效平衡,因为是恒温恒容,且反应前后气体系数之和不相等,因此从SO3开始,需要通入SO3的量为20mol,前一个SO2的转化率与后一个SO3的转化率的和为100%,即SO3的转化率为20%,故B正确;
答案为B。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】在3个体积均为4.0 L的恒容密闭容器中,反应 CO2(g)+C(s)![]() 2CO(g) ΔH > 0,分别在一定温度下达到化学平衡状态。下列说法正确的是
2CO(g) ΔH > 0,分别在一定温度下达到化学平衡状态。下列说法正确的是
容器 | 温度/K | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(CO2) | n(C) | n(CO) | n(CO) | ||
I | 977 | 0.56 | 1.12 | 0 | 0.8 |
II | 977 | 1.12 | 1.12 | 0 | x |
III | 1250 | 0 | 0 | 1.12 | y |
A.977 K,该反应的化学平衡常数值为4
B.达到平衡时,向容器I中增加C的量,平衡正向移动
C.达到平衡时,容器I中CO2的转化率比容器II中的大
D.达到平衡时,容器III中的CO的转化率大于28.6%
【题目】Ⅰ.氢气用于工业合成氨 N2(g) + 3H2(g) ![]() 2NH3(g);ΔH = -92.2 kJ·mol-1。一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t5 ﹑t7时刻所对应的实验条件改变分别是
2NH3(g);ΔH = -92.2 kJ·mol-1。一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t5 ﹑t7时刻所对应的实验条件改变分别是
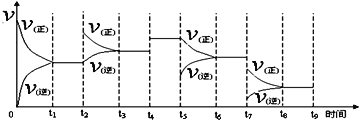
t5 ___________________。t7___________________。
Ⅱ.已知化学反应①:Fe(s)+CO2(g) ![]() FeO(s)+CO(g), 其平衡常数为K1;
FeO(s)+CO(g), 其平衡常数为K1;
化学反应②:Fe(s)+H2O(g) ![]() FeO(s)+H2(g),其平衡常数为K2。
FeO(s)+H2(g),其平衡常数为K2。
在温度973K和1173K情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973K | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
(1)1173K时,若c(CO2)=2mol/L,c(CO) =5mol/L,则此时反应①平衡向__________(填“正”或“逆”)反应方向移动。
(2)现有反应③CO2(g)+H2(g) ![]() CO(g)+H2O(g),写出该反应的平衡常数K3的表达式:K3=_______________________(用K1 、 K2表示)。据此关系式及上表数据,能推断出反应③是______(填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是______(填写序号)。
CO(g)+H2O(g),写出该反应的平衡常数K3的表达式:K3=_______________________(用K1 、 K2表示)。据此关系式及上表数据,能推断出反应③是______(填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是______(填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
能判断反应③已达平衡状态的是_______________________________。
A.恒容容器中压强不变 B.混合气体中c(CO)不变
C.![]() (H2)==
(H2)==![]() (H2O) D.c(CO2)==c(CO)
(H2O) D.c(CO2)==c(CO)
(3)723K时,0.2molCO2和0.1molH2通入抽空的1L恒容密闭容器中,发生反应③,达到平衡后水的物质的量分数为0.1。则H2的转化率α(H2)=___________%。723K该反应的平衡常数为K=________________。(结果保留两位有效数字)