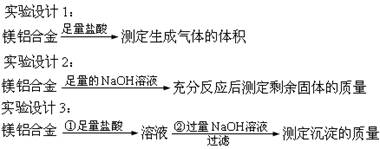
题目内容
(12分)如图为100mL 2 mol /L 的AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线。试回答:

(1) A点时已参加反应的AlCl3和NaOH的物质的量之比为1比 。
(2) AB段曲线所表示的反应的离子方程式是___________________。
(3) B处溶液中存在的物质的量浓度最大的离子是 (填离子符号)。向B处生成的溶液中通入二氧化碳,可见到的现象是 。
(4)如在该AlCl3溶液中生成7.8克沉淀,则消耗的氢氧化钠的物质的量为 mol或 mol。

(1) A点时已参加反应的AlCl3和NaOH的物质的量之比为1比 。
(2) AB段曲线所表示的反应的离子方程式是___________________。
(3) B处溶液中存在的物质的量浓度最大的离子是 (填离子符号)。向B处生成的溶液中通入二氧化碳,可见到的现象是 。
(4)如在该AlCl3溶液中生成7.8克沉淀,则消耗的氢氧化钠的物质的量为 mol或 mol。
(12分,每空2分) (1) 3;
(2) Al(OH)3+OH-=AlO2-+2H2O;
(3) Na+ ;生成白色沉淀。
(4)0.3mol或0.7mol
(2) Al(OH)3+OH-=AlO2-+2H2O;
(3) Na+ ;生成白色沉淀。
(4)0.3mol或0.7mol
A点沉淀达最大量,此时下列反应刚好完成:
AlCl3+3NaOH=Al(OH)3↓+3NaCl, AB段曲线所表
示的反应是沉淀刚好溶解:Al(OH)3+NaOH=NaAlO2+2H2O,离子反应为
Al(OH)3+OH-=AlO2-+2H2O;因此B处溶液中存在的物质是NaCl、NaAlO2浓度最大的离子是Na+,向B处生成的溶液中通入二氧化碳发生如下反应:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,有白色沉淀产生;
⑷当氢氧化钠量少:AlCl3+3NaOH=Al(OH)3↓+3NaCl
3mol 78g
n 7.8g n=0.3mol
当氢氧化钠量多,AlCl3全部反应产生沉淀,后沉淀溶解一部分
AlCl3+3NaOH=Al(OH)3↓+3NaCl
1mol 3mol 78g
0.2mol n m n=0.6mol m=15.6g
Al(OH)3+NaOH=NaAlO2+2H2O
78g 1mol
15.6g-7.8g n1 n1 =0.1mol,则消耗的氢氧化钠的物质的量为0.6mol+0.1mol=0.7mol。
AlCl3+3NaOH=Al(OH)3↓+3NaCl, AB段曲线所表
示的反应是沉淀刚好溶解:Al(OH)3+NaOH=NaAlO2+2H2O,离子反应为
Al(OH)3+OH-=AlO2-+2H2O;因此B处溶液中存在的物质是NaCl、NaAlO2浓度最大的离子是Na+,向B处生成的溶液中通入二氧化碳发生如下反应:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,有白色沉淀产生;
⑷当氢氧化钠量少:AlCl3+3NaOH=Al(OH)3↓+3NaCl
3mol 78g
n 7.8g n=0.3mol
当氢氧化钠量多,AlCl3全部反应产生沉淀,后沉淀溶解一部分
AlCl3+3NaOH=Al(OH)3↓+3NaCl
1mol 3mol 78g
0.2mol n m n=0.6mol m=15.6g
Al(OH)3+NaOH=NaAlO2+2H2O
78g 1mol
15.6g-7.8g n1 n1 =0.1mol,则消耗的氢氧化钠的物质的量为0.6mol+0.1mol=0.7mol。

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案
相关题目
 测定生成气体的体积为69.44L(标准状况)
测定生成气体的体积为69.44L(标准状况) 过滤,测定沉淀的质量为5.8g
过滤,测定沉淀的质量为5.8g