题目内容
在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
| A.2Na2O2+2H2O=4NaOH+O2↑ |
| B.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑ |
| C.Cl2+H2O=HClO+HCl |
| D.CaC2+2H2O―→Ca(OH)2+C2H2↑ |
A
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是
| A.构成单质分子的微粒一定含有共价键 |
| B.熔融时能导电的化合物,一定是离子化合物 |
| C.水加热至1000℃也不分解,是由于水分子间存在氢键 |
| D.由H原子形成1molH-H键所要吸收的能量就等于H-H的键能 |
下列各图中的大黑点代表原子序数从1~18号元素的原子实(原子实是原子除最外层电子
后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键。下列各图表示的结构与化学式一定不相符的是( )
| A | B | C | D |
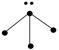 |  | 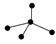 |  |
| NH3 | C2H4 | CCl4 | CO2 |
下列说法正确的是( )。
| A.离子键就是阴、阳离子间的静电引力 |
| B.所有金属元素与所有非金属元素间都能形成离子键 |
| C.钠原子与氯原子结合成氯化钠后体系能量降低 |
| D.在离子化合物CaCl2中,两个氯离子间也存在离子键 |
下列各分子中,所有原子都满足最外层8电子稳定结构的是( )。
| A.H2O | B.BF3 | C.CCl4 | D.PCl5 |
以下叙述中错误的是( )。
| A.钠原子和氯原子作用生成NaCl后,其结构的稳定性增强 |
| B.在氯化钠中,氯离子和钠离子靠静电作用结合 |
| C.任何离子键在形成的过程中必定有电子的得与失 |
| D.金属钠与氯气反应生成氯化钠后,体系能量降低 |
观察下表模型并结合有关信息,判断下列说法中不正确的是( )
| | B12结构单元 | SF6分子 | S8分子 | HCN |
| 结构模型示意图 | 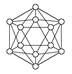 | 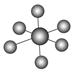 | 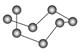 | 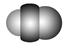 |
| 备注 | 熔点1873 K | — | 易溶于CS2 | — |
A.单质硼属于原子晶体,每个B12结构单元中含有30个B—B键和20个正三角形
B.SF6是由极性键构成的非极性分子
C.固态硫S8属于原子晶体
D.HCN的结构式为H—C≡N
下列叙述中,不正确的是 ( )。
| A.只有非金属原子间才能形成共价键 |
| B.共价化合物中不可能含有离子键 |
| C.单质中不可能含有离子键 |
| D.非金属单质中不一定含有共价键 |
具有手性碳原子的物质往往具有旋光性,存在对映异构体,下列化合物中存在对映异构体的是( )。
| A.C2H5CH=CHCH(CH3)—CH=CHC2H5 |
| B.2甲基丁烷 |
| C.甲酸 |
| D.C6H5CH(CH3)CHO |