题目内容
【题目】随原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
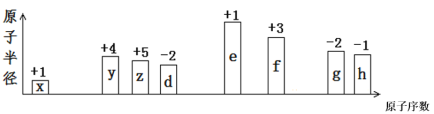
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________________。
(2)比较d、e常见离子的半径大小(用化学式表示)___________________;
(3)z的简单氢化物与z的最高价氧化物的水化物形成的化合物中化学键类型为:_______________________。
(4)元素y的一种同位素可用于测定文物年代,这种同位素原子符号为___________。
(5)元素g与元素h相比,非金属性较强的是_________(用元素符号表示),下列表述中能证明这一事实的是_________(填序号)。
a.常温下g的单质和h的单质状态不同
b.h的氢化物比g的氢化物稳定
c.一定条件下g和h的单质都能与氢氧化钠溶液反应
d.g、h最高价氧化物对应水化物的酸性前者弱于后者
(6)x、e反应可生成离子化合物ex。
①写出化合物ex的电子式__________________。
②将少量ex投入水中,剧烈反应,得到x单质。
写出反应的化学方程式:_____________________________________________;
【答案】第三周期 ⅢA族 O2->Na+ 离子键 共价键 ![]() C Cl bd
C Cl bd ![]() NaH+H2O=NaOH+H2↑
NaH+H2O=NaOH+H2↑
【解析】
推此题元素需运用元素周期律知识:同周期元素原子半径逐渐减小,最高正价逐渐增大,最低负价绝对值逐渐减小。依此规律并结合图表可推出图中所列各种元素:x原子半径最小,最高+1价,是H;y、z、d属第二周期元素,根据最高或最低化合价分别为+4、+5、-2,可知分别是C、N、O;e、f、g、h为第三周期元素,根据其最高正价或最低负价分别为+1、+3、-2、-1可推出它们分别是Na、Al、S、Cl。在此基础上,结合元素化合物知识,可对各小题进行解答。
(1)f是Al,位于元素周期表中第三周期、第IIIA族,所以答案为:第三周期 IIIA族。
(2)d、e分别是O、Na,常见离子分别是O2-、Na+,它们均为10电子粒子,O的核电荷数比Na的小,所以半径关系是:O2->Na+。答案为:O2->Na+。
(3)z是N,简单氢化物(NH3)和最高价氧化物的水化物(HNO3)形成的NH4NO3是离子化合物,含离子键;![]() 中氮氢键、
中氮氢键、![]() 中的氮氧键均为共价键,所以答案为:离子键 共价键。
中的氮氧键均为共价键,所以答案为:离子键 共价键。
(4)y是C,其同位素C-14可用于测定文物年代,所以答案为:![]() C 。
C 。
(5)g是S,h是Cl,同周期主族元素原子序数越大非金属性越强,所以Cl非金属性比S强;单质的状态不能用于非金属性的比较,a错;非金属性越强氢化物越稳定,b对;与氢氧化钠溶液反应是共同的性质,不能用于区别非金属性,c错;最高价氧化物对应水化物的酸性越强,非金属性越强,d对。故答案为:Cl; bd。
(6)x、e分别是H、Na,形成的离子化合物是NaH,①NaH是由Na+和H-构成,所以电子式为![]()
;②-1价氢还原性强,NaH投入水中,所含负一价氢能与水中正一价氢发生归中反应生成氢气:NaH+H2O=NaOH+H2↑。故答案为:![]() NaH+H2O=NaOH+H2↑。
NaH+H2O=NaOH+H2↑。