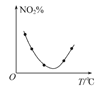
��Ŀ����
����Ŀ����NaOH��MgCl2��AlCl3���ֹ�����ɵĻ������������ˮ����1.16g��ɫ�����������õ���Һ����μ���1molL��1 HCl��Һ������HCl��Һ����������ɳ�����������ϵ��ͼ��ʾ���Իش�
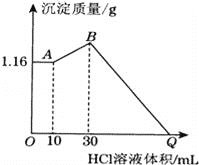
��1��д�����������ˮʱ������Ӧ�����ӷ���ʽ________________________________________________��
��2��д��AB�η�Ӧ�����ӷ���ʽ__________________��B��ij�����Ļ�ѧʽΪ______________��
��3����ԭ�������AlCl3�����ʵ���____________��NaOH������________________��
��4����Q������HCl��Һ�����______________________��
���𰸡� Mg2++2OH��=Mg��OH��2����Al3++4OH��=AlO2��+2H2O�� H2O+AlO2��+H+=Al��OH��3�� Mg��OH��2��Al��OH��3 0.02 5.20 130
��������������������⿼����Al��OH��3��Mg��OH��2�����йص�ͼ������ͼ�����
��1����ʼ����10mLHCl��Һ�������������Ȳ�����Ҳ�����٣�˵����ʱ�����10mL������NaOH��Ӧ����ԭ������������ˮ�����ķ�Ӧ����MgCl2+2NaOH=Mg��OH��2��+2NaCl��AlCl3+4NaOH=3NaCl+NaAlO2+2H2O��1.16g��ɫ����ΪMg��OH��2��ԭ������������ˮ������Ӧ�����ӷ���ʽΪ��Mg2++2OH-=Mg��OH��2����Al3++4OH-=AlO2-+2H2O��
��2��AB�η�����Ӧ�����ӷ���ʽΪAlO2-+H++H2O=Al��OH��3����B�������Ļ�ѧʽΪMg��OH��2��Al��OH��3��
��3��AB������n��HCl��=1mol/L![]() ��0.03L-0.01L��=0.02mol������Al�غ�����ӷ�ӦAlO2-+H++H2O=Al��OH��3����n��AlCl3��=n��AlO2-��=n[Al��OH��3]=0.02mol�����ݷ�ӦAl3++4OH-=AlO2-+2H2O����AlCl3��Ӧ��NaOH���ʵ���Ϊ0.08mol����MgCl2��=n[Mg��OH��2]=
��0.03L-0.01L��=0.02mol������Al�غ�����ӷ�ӦAlO2-+H++H2O=Al��OH��3����n��AlCl3��=n��AlO2-��=n[Al��OH��3]=0.02mol�����ݷ�ӦAl3++4OH-=AlO2-+2H2O����AlCl3��Ӧ��NaOH���ʵ���Ϊ0.08mol����MgCl2��=n[Mg��OH��2]= ![]() =0.02mol�����ݷ�ӦMg2++2OH-=Mg��OH��2������MgCl2��Ӧ��NaOH���ʵ���Ϊ0.04mol����HCl��Ӧ��NaOH���ʵ���Ϊ1mol/L
=0.02mol�����ݷ�ӦMg2++2OH-=Mg��OH��2������MgCl2��Ӧ��NaOH���ʵ���Ϊ0.04mol����HCl��Ӧ��NaOH���ʵ���Ϊ1mol/L![]() 0.01L=0.01mol��ԭ�������NaOH���ʵ���Ϊ0.08mol+0.04mol+0.01mol=0.13mol��NaOH������Ϊ0.13mol
0.01L=0.01mol��ԭ�������NaOH���ʵ���Ϊ0.08mol+0.04mol+0.01mol=0.13mol��NaOH������Ϊ0.13mol![]() 40g/mol=5.2g��
40g/mol=5.2g��
��3��BQ�η����ķ�ӦΪMg��OH��2+2HCl=MgCl2+2H2O��Al��OH��3+3HCl=AlCl3+3H2O���ܽ�Mg��OH��2���ĵ�HCl���ʵ���Ϊ0.02mol![]() 2=0.04mol���ܽ�Al��OH��3���ĵ�HCl���ʵ���Ϊ0.02mol
2=0.04mol���ܽ�Al��OH��3���ĵ�HCl���ʵ���Ϊ0.02mol![]() 3=0.06mol����BQ������HCl���ʵ���Ϊ0.04mol+0.06mol=0.1mol��������������Ϊ
3=0.06mol����BQ������HCl���ʵ���Ϊ0.04mol+0.06mol=0.1mol��������������Ϊ![]() =0.1L=100mL����Q�������������Ϊ30mL+100mL=130mL��
=0.1L=100mL����Q�������������Ϊ30mL+100mL=130mL��

����Ŀ���Է�Ӧ5H2C2O4+2MnO4-+6H+===10CO2��+2Mn2++8H2OΪ��̽������������Ի�ѧ��Ӧ���ʵ�Ӱ������ʵ��ʱ���ֱ���ȡH2C2O4��Һ������KMnO4��Һ��Ѹ�ٻ�ϲ���ʼ��ʱ��ͨ���ⶨ��Һ��ɫ����ʱ�����жϷ�Ӧ�Ŀ�����
��� | H2C2O4��Һ | ����KMnO4��Һ | �¶�/�� | ||
Ũ��/mol��L-1 | ���/mL | Ũ��/mol��L-1 | ���/mL | ||
�� | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
�� | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
�� | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
����˵������ȷ����
A. ʵ��������������ӵ�H2C2O4��Һ��Ҫ����
B. ʵ��ٲ��KMnO4��Һ����ɫʱ��Ϊ40 s�������ʱ����ƽ����Ӧ������(KMnO4)=2.5��10-4mol��L-1��s-1
C. ������a L CO2����״�������÷�Ӧת�Ƶĵ�����ΪaNA/22.4
D. ʵ��ٺ͢������Ӧ������������һ�������ͻȻ�����������ɵ�Mn2+�Է�Ӧ�������