题目内容
Cu(OH)2在水溶液中存在着如下沉淀溶解平衡:Cu(OH)2(s)  Cu2+(aq)+2OH-(aq),在常温下Ksp=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol/L的CuSO4溶液中加入碱来调整溶液的pH,应使溶液的pH大于( )
Cu2+(aq)+2OH-(aq),在常温下Ksp=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol/L的CuSO4溶液中加入碱来调整溶液的pH,应使溶液的pH大于( )
| A.2 | B.3 | C.4 | D.5 |
D
解析试题分析:根据溶度积规则知,若要生成氢氧化铜沉淀则有Q[Cu(OH)2]= c(Cu2+)c2(OH—)>Ksp[Cu(OH)2],代入题给数据计算得c(OH—)>1×10-9mol·L-1,常温下Kw=c(H+)·c(OH—)=1×10-14,则c(H+)<1×10-5mol·L-1,pH>5,选D。
考点:考查难溶物的沉淀溶解平衡。

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
为了除去MgCl2酸性溶液中的 Fe3+,可在加热搅拌条件下加入一种试剂,过滤后,在向滤液中加入适量的盐酸,这种试剂是
| A.NaOH | B.NH3·H2O | C.MgCl2 | D.MgCO3 |
下列溶液中离子浓度的关系一定正确的是
A. 和 和 溶液中: 溶液中: |
B.一元弱碱MOH对应的盐MCl溶液中: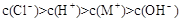 |
C.等物质的量的一元弱酸HX与其钾盐KX的混合溶液中: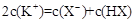 |
| D.pH=3的一元酸HX和pH=11的一元碱MOH等体积混合: |
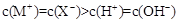
氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是
| A.HCN易溶于水 |
| B.HCN溶液能导电 |
| C.1mol/L氢氰酸溶液的pH约为3 |
| D.10 mL1 mol·L-1HCN恰好与10 mL 1 mol·L-1 NaOH溶液完全反应 |
25℃时,下列溶液中水的电离程度最小的是
| A.0.01 mol/L盐酸 | B.0.01 mol/L Na2CO3溶液 |
| C.pH =" 4" NaHSO3溶液 | D.pH =11氨水 |
已知温度T时水的离子积常数为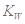 。该温度下,将浓度为amol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
。该温度下,将浓度为amol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
| A.a=b |
| B.混合溶液的pH=7 |
C.混合溶液中,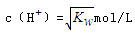 |
D.混合溶液中,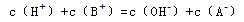 |
物质的量浓度相同的下列物质中,含粒子种类最多的是
| A.CaCl2 | B.CH3COONa | C.K2S | D.NH3 |
室温下,甲、乙两烧杯均盛有5mlpH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4,关于甲、乙两烧杯中溶液的描述正确的是
| A.溶液的体积:10V甲≤V乙 |
| B.水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙 |
| C.若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 |
| D.若分别与5mlpH=11的NaOH溶液反应,所得溶液的pH:甲≤乙 |