题目内容
【题目】漂白液、漂白粉和漂粉精既可作棉、麻、纸张的漂白剂,又可用作游泳池及环境的消毒剂.它们在生产、生活中有广泛应用.某实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液,其中有效成分为NaClO)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.
(1)小组成员甲同学依据漂白液具有漂白消毒的性质推测,漂白液中ClO﹣具有氧化性.进行如下实验: Ⅰ.取10mL漂白液,依次加入Na2SO3溶液和BaCl2溶液,观察到有白色沉淀生成,经检验白色沉淀不溶于盐酸.
Ⅱ.另取10mL漂白液,加入品红溶液,发现溶液红色逐渐变浅,一段时间后褪为无色.
Ⅲ.再取10mL漂白液,加入品红溶液,加入少量稀硫酸酸化后,观察溶液红色立即变为无色.
①由实验Ⅰ得出ClO﹣具有氧化性,写出相关反应的离子方程式 .
②对比实验Ⅱ和Ⅲ说明ClO﹣氧化性与溶液酸碱性的关系是 .
(2)小组成员乙同学依据(1)中的实验提出:漂白液在酸性溶液中有Cl2生成,为此进行如下实验: 首先,他利用pH计分别测得漂白液pH>7,饱和KAl(SO4)2溶液pH<7.然后用下图1所示的装置继续实验,探究漂白液在酸性溶液中是否能反应生成Cl2 . 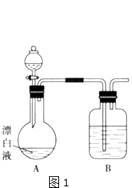
①在测定漂白液pH的实验中,乙同学没有选择pH试纸的理由可能是;
②若打开分液漏斗活塞向烧瓶中加入硫酸,不久烧瓶中有黄绿色气体产生.A中反应的离子方程式 .
③若打开分液漏斗活塞向烧瓶中加入饱和KAl(SO4)2溶液,预计只有观察到以下现象 , 才能说明漂白液与酸性溶液混合会产生Cl2 .
(3)为了进一步了解漂白液生产和保存的实际意义,小组其他成员还研究漂白液的稳定性,他们查阅资料,下图是30℃时,pH=11的漂白液中NaClO的质量百分含量随时间变化图2: 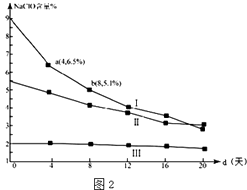
①分析分解速率v(Ⅰ)与v(Ⅱ)的大小关系,原因是
②4d~8d,Ⅰ中v(NaClO)=mol/(Ld)(常温下漂白液的密度约为1g/cm3 , 且溶液体积变化忽略不计,结果保留2位有效数字.)
【答案】
(1)ClO﹣+SO32﹣=Cl﹣+SO42﹣、Ba2++SO42﹣=BaSO4↓或Ba2++ClO﹣+SO32﹣=BaSO4↓+Cl﹣;ClO﹣的氧化性随氢离子浓度增大而增大
(2)漂白液具有漂白性,pH试纸变蓝后马上褪色,无法准确测定pH;ClO﹣+Cl﹣+2H+=Cl2↑+H2O;产生大量的白色胶状沉淀,不久烧瓶中有黄绿色气体产生
(3)在相同条件下,次氯酸钠的浓度越大,其分解速率越大;0.047
【解析】解:(1)①②Ⅱ中由白色沉淀生成,经检验白色沉淀不溶于盐酸,可知白色沉淀为BaSO4 , 发生氧化还原反应,ClO把SO32氧化为SO42,所以离子方程式为:ClO﹣+SO32﹣=Cl﹣+SO42﹣、Ba2++SO42﹣=BaSO4↓或Ba2++ClO﹣+SO32﹣=BaSO4↓+Cl﹣ , 所以答案是:ClO﹣+SO32﹣=Cl﹣+SO42﹣、Ba2++SO42﹣=BaSO4↓或Ba2++ClO﹣+SO32﹣=BaSO4↓+Cl﹣;②加入少量稀硫酸酸化后,观察溶液红色立即变为无色,说明ClO﹣的氧化性随c(H+)增大而增强,由上述两个实验对比可知,加入酸,反应速率加快,则ClO﹣的氧化性随氢离子浓度增大而增大,所以答案是:ClO﹣的氧化性随氢离子浓度增大而增大;(2)①在测定漂白液pH的实验中,乙同学没有选择pH试纸的理由可能是,漂白液具有漂白性,可以漂白pH试纸,无法准确测定pH,所以答案是:漂白液具有漂白性,pH试纸变蓝后马上褪色,无法准确测定pH;②在酸性条件下,ClO与Cl发生氧化还原反应生成Cl2 , 则离子方程式为:ClO﹣+Cl﹣+2H+=Cl2↑+H2O,所以答案是:ClO﹣+Cl﹣+2H+=Cl2↑+H2O;③若打开分液漏斗活塞向烧瓶中加入饱和KAl(SO4)2溶液,Al3+水解使溶液呈酸性:Al3++3H2OAl(OH)3↓+3H+ , 若漂白液与H+反应,Al3+水解平衡向右移动,产生大量的白色胶状沉淀,不久烧瓶中有黄绿色气体产生,预计只有观察到以下现象产生大量的白色胶状沉淀,不久烧瓶中有黄绿色气体产生,才能说明漂白液与酸性溶液混合会产生Cl2 . 所以答案是:才能说明漂白液与酸性溶液混合会产生Cl2;(3)①图2为NaClO的质量百分含量,在相同时间内,NaClO的质量百分含量改变越大,则v(Ⅰ)>v(Ⅱ),v(Ⅰ)时NaClO的浓度大于v(Ⅱ)时NaClO的浓度,在相同的条件下,NaClO的浓度越大分解速率越大.所以答案是:>;在相同条件下,次氯酸钠的浓度越大,其分解速率越大;②4d~8d,NaClO的含量由6.5%变为5.1%,假设溶液体积为1L,v(NaClO)=[(6.5%﹣5.1%)×1g/mL×103÷74.5g/mol]÷4d=0.047mol/(L.d),所以答案是:0.047.

【题目】“一碳化学”是指以含一个碳原子的化合物(如:CO2、CO、CH4、CH3OH等)为初始反应物,合成一系列重要的化工原料和燃料的化学。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)=NH2COONH4(s)△H1
反应II:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol
总反应:2NH3(g)+CO2(g)==CO(NH2)2(s)+H2O(g) △H3=-86.98kJ/mol
请回答下列问题:
①反应I的△H1=______ kJ/mol
②反应II一般在_________(填“高温”或“低温”)情况下有利于该反应的进行。
③一定温度下,在体积为固定的密闭容器中按计量比进行反应I,下列能说明反应达到了平衡状态的是__________(填序号)。
A.混合气体的平均相对分子质量不再变化 B.容器内气体总压强不再变化
C.2V正(NH3)=V逆(CO2) D.容器内混合气体的密度不再变化
④环境为真空时,在一敞开容器(非密闭容器)中加入NH2COONH4固体,足够长时间后,反应是否建立平衡状态? ___________(填“是”或“否”)
(2)将CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。
CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。
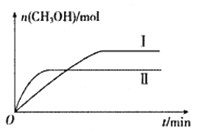
①曲线I.II对应的平衡常数大小关系为KI_______KII(填“ >”、“<”或“=”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | amolCO2、bmolH2 cmol CH3OH(g)、cmolH2O(g)(a、b、c均不为零) |
若甲容器平衡后气体的压强为开始的0.8倍,则甲容器平衡混合气体中CH3OH(g)的体积分数为_______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,乙容器中c的取值范围为________。
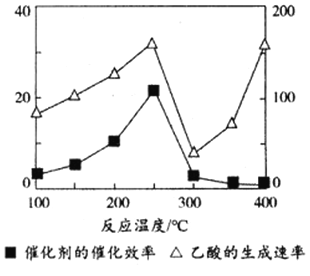
(3)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如下图,乙酸的生成速率主要取决于温度影响的范围是________________。
【题目】下列关于化合物,单质,混合物,电解质和非电解质的正确组合是( )
化合物 | 单质 | 混合物 | 电解质 | 非电解质 | |
A | 烧碱 | 液态氧 | 冰水混合物 | 醋酸 | 三氧化硫 |
B | 生石灰 | 白磷 | 胆矾 | 氧化铝 | 氯气 |
C | 干冰 | 铁 | 氨水 | 石灰石 | 酒精 |
D | 空气 | 氮气 | 小苏打 | 氯化铜 | 硫酸钡 |
A. A B. B C. C D. D

