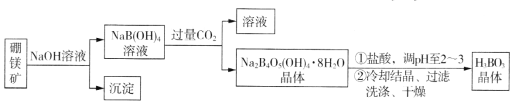
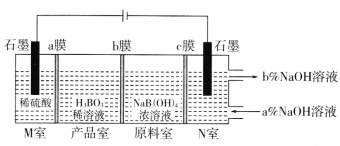
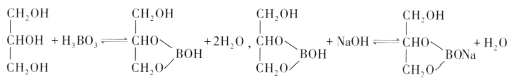题目内容
【题目】I. 某可逆反应在某体积为2L的密闭容器中进行,在从0~3min各物质的量的变化情况如图所示(A、B、C均为气体)
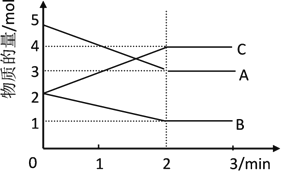
(1)该反应的化学方程式为______
(2)反应开始至2min时,B的平均反应速率为______
(3)能说明该反应已达到平衡状态的是______
A. c(A)= c(B)= c(C) B. 容器内压强保持不变 C . v逆(A)= v正(C) D. c(C)不再变化
(4)由图求得A的平衡时的转化率为______
【答案】2A+B![]() 2C 0.25 mol·L-1·min-1 BCD 0.4(或40%)
2C 0.25 mol·L-1·min-1 BCD 0.4(或40%)
【解析】
(1)从物质的量的变化趋势判断反应物和生成物,根据物质的量变化值等于化学计量数之比书写化学方程;
(2)化学反应速率是单位时间内浓度的变化,据此可求得反应速率;
(3)根据平衡状态的判断标志可以作出判断;
(4)A的平衡时的转化率为A达到平衡时已转化的物质的量与起始的物质的量之比。
(1)由图象可以看出,A、B的物质的量逐渐减小,则A、B为反应物,C的物质的量逐渐增多,所以C为生成物,当反应到达2min时,△n(A)=2mol,△n(B)=1mol,△n(C)=2mol,化学反应中,各物质的量的变化值与化学计量数呈正比,则△n(A):△n(B):△n(C)=2:1:2,所以反应的化学方程式为:2A+B![]() 2C;
2C;
(2)由图象可以看出,反应开始至2分钟时,△n(B)=1mol,B的平均反应速率为![]() 0.25 mol·L-1·min-1;
0.25 mol·L-1·min-1;
(3)A、浓度不变为平衡状态,c(A)= c(B)= c(C)不能说明浓度不变,故无法判断反应是否达到平衡,故不选A;
B、该反应为前后气体体积变小的反应,随着正反应的进行,气体物质的量不断减小,压强也减小,当压强不变时,说明反应已达平衡状态,故选B;
C、在该反应中A和C的计量数相等,所以当v逆(A)=v正(C)时,可以说明反应已达平衡状态了,故选C;
D、浓度不变为平衡状态,所以c(C)不再变化一定达到平衡状态,故选D。
(4)由图可知:达平衡时,△n(A)=2mol,所以A的转化率为![]() 40%。
40%。