题目内容
(1)质量都是50g的HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是 ,在同温同压下,体积最大的是 .
(2)在一定条件下,ROn2-和氯气可以发生如下反应:ROn2-+Cl2+2OH-═RO42-+2Cl-+H2O
由以上反应可知在ROn2-中,元素R的化合价是 .
(3)中和相同体积、相同物质的量浓度的NaOH溶液,使其生成正盐,需要相同物质的量浓度的盐酸、硫酸、磷酸的体积比为 .
(2)在一定条件下,ROn2-和氯气可以发生如下反应:ROn2-+Cl2+2OH-═RO42-+2Cl-+H2O
由以上反应可知在ROn2-中,元素R的化合价是
(3)中和相同体积、相同物质的量浓度的NaOH溶液,使其生成正盐,需要相同物质的量浓度的盐酸、硫酸、磷酸的体积比为
考点:物质的量的相关计算
专题:计算题
分析:(1)根据n=
=
、n=
=
进行判断质量相等时含有分子数目最少的、在同温同压下,体积最大的气体;
(2)由氧原子质量守恒计算出n=3,则RO32-中R的化合价为+4价;
(3)盐酸为一元酸,硫酸为二元酸,磷酸为三元酸,n(NaOH)是相等的,令n(NaOH)=1mol,计算需要酸、硫酸、磷酸的物质的量,三种酸的浓度相等则其体积之比等于物质的量之比.
| m |
| M |
| N |
| NA |
| m |
| M |
| V |
| Vm |
(2)由氧原子质量守恒计算出n=3,则RO32-中R的化合价为+4价;
(3)盐酸为一元酸,硫酸为二元酸,磷酸为三元酸,n(NaOH)是相等的,令n(NaOH)=1mol,计算需要酸、硫酸、磷酸的物质的量,三种酸的浓度相等则其体积之比等于物质的量之比.
解答:
解:(1)由n=
=
可知,相同质量时,气体的摩尔质量越大,物质的量越小,则分子数越少,因M(CO2)>M(HCl)>M(O2)>M(NH3),则含有分子数目最少的是CO2,
由n=
=
可知,相同质量时,气体的摩尔质量越大,物质的量越小,在相同温度和相同压强条件下,气体的体积越小,反之越大,则体积最大的是NH3,最小的是CO2,
故答案为:CO2;NH3;
(2)由氧原子质量守恒:n+2=4+1,解得n=3,据化合价代数和为0的原则可知RO32-中R的化合价为+4价,
故答案为:+4;
(3)相同体积、相同物质的量浓度的NaOH溶液溶质的物质的量相同,令n(NaOH)=1mol,
盐酸为一元酸,生成正盐消耗n(HCl)=n(NaOH)=1mol,
硫酸为二元酸,生成正盐消耗n(硫酸)=
n(NaOH)=
mol,
磷酸为三元酸,生成正盐消耗n(磷酸)=
n(NaOH)=
mol,
三种酸的物质的量浓度相同,体积之比等于物质的量之比,故它们的体积比为1mol:
mol:
mol=6:3:2,
故答案为:6:3:2.
| m |
| M |
| N |
| NA |
由n=
| m |
| M |
| V |
| Vm |
故答案为:CO2;NH3;
(2)由氧原子质量守恒:n+2=4+1,解得n=3,据化合价代数和为0的原则可知RO32-中R的化合价为+4价,
故答案为:+4;
(3)相同体积、相同物质的量浓度的NaOH溶液溶质的物质的量相同,令n(NaOH)=1mol,
盐酸为一元酸,生成正盐消耗n(HCl)=n(NaOH)=1mol,
硫酸为二元酸,生成正盐消耗n(硫酸)=
| 1 |
| 2 |
| 1 |
| 2 |
磷酸为三元酸,生成正盐消耗n(磷酸)=
| 1 |
| 3 |
| 1 |
| 3 |
三种酸的物质的量浓度相同,体积之比等于物质的量之比,故它们的体积比为1mol:
| 1 |
| 2 |
| 1 |
| 3 |
故答案为:6:3:2.
点评:本题考查了有关物质的量的计算、酸碱中和反应、元素化合价的计算,题目难度中等,注意掌握根据反应方程式进行的有关物质的量的计算方法,明确酸碱中和反应的实质,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5.则下列有关比较中正确的是( )
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5.则下列有关比较中正确的是( )
| A、第一电离能:③>①>② |
| B、原子半径:③>②>① |
| C、电负性:③>①>② |
| D、最高正化合价:③>②>① |
对有机物CH3CH=CH-C≡CH结构的描述正确的是( )
| A、分子中所有碳原子在同一直线上 |
| B、分子中所有氢原子一定在同一平面内 |
| C、分子中在同一平面内的原子最多有6个 |
| D、分子中在同一平面内的原子最多有9个 |
下列溶液中微粒的物质的量浓度关系正确的是( )
| A、25℃时,pH=7的NH4Cl与NH3?H2O混合溶液:c(H+)=c(OH-)=c(NH4+)=c(Cl-) |
| B、0.1mol/L Na2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C、25℃时,pH=2的HCOOH与pH=12的NaOH等体积混合:c(HCOO-)+c(H+)>c(Na+)+c(OH-) |
| D、0.1mol/L Na2CO3溶液与0.1mol/L NaHCO3溶液等体积混合:2c(CO32-)+2c(HCO3-)+2c(H2CO3)=3c(Na+) |
2011年3月11日13时46分,日本发生9.0级地震.强震导致日本福岛第一核电站发生严重核泄漏.据新华社4月8日电,在我国30省份部分地区空气中监测到放射性核素碘-131.下列有关说法中正确的是( )
| A、碘-131指的是碘元素的质子数是131 | ||||
B、
| ||||
C、碘-131(
| ||||
D、
|
能正确表示下列反应的离子方程式是( )
| A、石灰石溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O |
| B、氯化铝溶液中加入过量的氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
| C、硫酸亚铁溶液中通入足量的氯气:Fe2++Cl2=Fe3++2Cl- |
| D、锌与稀硝酸反应:Zn+2H+=Zn2++H2↑ |
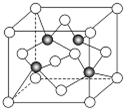 目前大量的照明材料或屏幕都使用了发光二极管(LED).市售LED晶片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主.已知镓是铝同族下一周期的元素.砷化镓的晶胞结构如图.试回答:
目前大量的照明材料或屏幕都使用了发光二极管(LED).市售LED晶片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主.已知镓是铝同族下一周期的元素.砷化镓的晶胞结构如图.试回答: