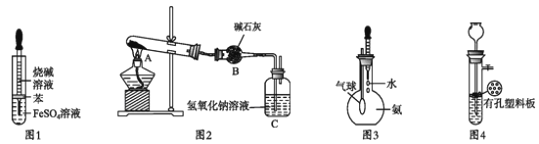
题目内容
【题目】根据图,下列判断中正确的是
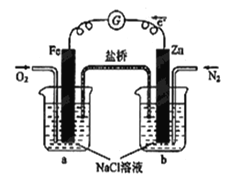
A.向烧杯a中加入少量KOH溶液,有白色沉淀生成
B.烧杯b中发生反应为2Zn-4eˉ=2Zn2+
C.电子从Zn极流出,流入Fe极,经盐桥回到Zn极
D.烧杯a中发生反应O2 + 4H++ 4eˉ= 2H2O,溶液pH降低
【答案】B
【解析】
试题分析:根据图示,该装置为原电池。锌是负极,铁是正极;负极反应为Zn-2eˉ=Zn2+;正极反应为O2 + 2H2O + 4eˉ=4OH-;向烧杯a中加入少量KOH溶液,无现象,故A错误;烧杯b中发生反应为2Zn-4eˉ=2Zn2+,故B正确;电子不能通过盐桥,故C错误;烧杯a中发生反应O2 + 2H2O + 4eˉ=4OH-,溶液pH升高,故D错误。

练习册系列答案
 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目