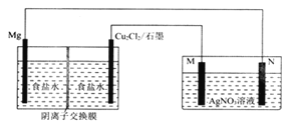
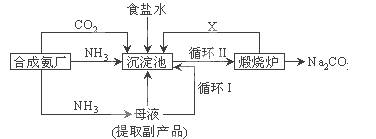
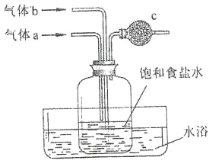
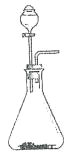
题目内容
【题目】已知 Ca(OH)2 与 Cl2 反应的氧化产物与温度有关,在一定量的石灰乳中通入足量的氯气,二者恰好完全反应。生成 Cl-、ClO-、ClO3- 三种含氯元素的离子,其中 ClO- 、ClO3- 两种离子的物质的量(n)与反应时间
(t)的曲线如图所示。

(1)t1 时,开始有 ClO3-生成的原因是_____。
(2)t2 时,Ca(OH)2 与 Cl2 发生反应的总的化学方程式为___________。
(3)该石灰乳中含有 Ca(OH)2 的物质的量是________mol。
(4)若反应物的量不变,在某温度下恰好完全反应时,氧化产物比值为![]() a ,则 n(Cl-)=_____mol
a ,则 n(Cl-)=_____mol
(用含 a 的代数式来表示)。
【答案】反应放热使温度升高,在较高温度下可生成 ClO3-10Cl2+10Ca(OH)2=Ca(ClO3)2+2Ca(ClO)2+7CaCl2+10H2O5![]()
【解析】
(1)由已知条件可知,氢氧化钙和氯气反应的氧化产物与温度有关,放热反应使温度升高,在较高温度下可生成ClO3-;
(2)由图可知,t2时n(ClO-)=2mol,n(ClO3-)=1mol,所以氯气与氢氧化钙反应生成CaCl2、Ca(ClO)2、Ca(ClO3)2、H2O,且n[Ca(ClO)2]:n[Ca(ClO3)2]=2:1,配平书写方程式;
(3)由图可知,t2时氢氧化钙与氯气恰好反应,n(C1O-)=2mol,故n[Ca(ClO)2]=1mol,n(ClO3-)=1mol,故n[Ca(ClO3)2]=0.5mol,根据方程式计算;
(4)参加反应的氯气n(Cl2)=n[Ca(OH)2]=5mol,根据氯元素守恒可知,n(ClO-)+ n(ClO3-) +n(Cl-)=2n(Cl2)=10mol,若n(ClO-)/n(ClO3-)=a,则an(ClO3-)+ n(ClO3-)=10-n(Cl-),根据电子转移守恒有,a n(ClO3-)+5 n(ClO3-) =n(Cl-),联立方程计算n(Cl-)。
(1)由图可知,t1前发生Cl2+Ca(OH)2=Ca2++Cl-+ClO-+H2O,该反应为放热反应,温度升高,t1时开始反应生成Ca(ClO3)2;正确答案:反应放热使温度升高,在较高温度下可生成 ClO3-。
(2)由图可知,t2时n(ClO-)=2mol,n(ClO3-)=1mol,所以n(ClO-)/n(ClO3-)=2;氯气与氢氧化钙反应生成CaCl2、Ca(ClO)2、Ca(ClO3)2、H2O,且n[Ca(ClO)2]:n[Ca(ClO3)2]=2:1,反应方程式为10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O;正确答案:10Cl2+10Ca(OH)2=Ca(ClO3)2+2Ca(ClO)2+7CaCl2+10H2O。
(3)由图可知,t2时氢氧化钙与氯气恰好反应,n(ClO-)=2mol,故n[Ca(ClO)2]=1mol, n(ClO3-)=1mol,故n[Ca(ClO3)2]=0.5mol,根据方程式10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O可知,n[Ca(OH)2]=10n[Ca(ClO3)2]=0.5mol×10=5mol;正确答案: 5。
(4)由(3)可知,参加反应的氯气n(Cl2)=n[Ca(OH)2]=5mol,根据氯元素守恒可知,n(ClO-)+ n(ClO3-)+n(Cl-)=2n(Cl2)=10mol,若n(ClO-)/n(ClO3-)=a,则a n(ClO3-)+ n(ClO3-)=10-n(Cl-),根据电子转移守恒有,a n(ClO3-)+5 n(ClO3-)=n(Cl-),联立方程解得, n(ClO3-)=5a+3,则n(Cl-)=(5a+25)/(a+3);正确答案:![]() 。
。