题目内容
(15分)A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:
回答以下问题(化学用语中的元素用相应的元素符号表示)。
(1)C在元素周期表中的位置是 。
(2)B、D元素对应的相对分子质量最小的氢化物受热分解所需温度B D(填“>”、“<”或“=”)。
(3)检验E3+离子的方法是 。
(4)鉴别D的两种氧化物的试剂是 (仅限一种);常温常压下DO2与一氧化碳反应生成 1.6g D单质与另一种氧化物,并放出14.86kJ的热量,写出此反应的热化学方程式 。
(5)0.1mol·L-1C2D溶液中各种离子浓度从大到小的顺序是 。
(6)AO2、O2和熔融NaAO3可制作燃料电池,其原理如图所示。该电池在使用过程电极Ⅰ生成氧化物Y,写出电极Ⅱ的反应式 。

| 元素 | A | B | C | D | E |
| 相关 信息 | 最高正价与最低负价代数和为2 | 与元素C可形成离子个数比为2:1和1:1的化合物 | 单质质软,通常保存在煤油中 | D元素可形成两种氧化物,其中一种是形成酸雨的主要成分 | 其单质是用途最广泛的金属,人体缺少该元素易患贫血症 |
(1)C在元素周期表中的位置是 。
(2)B、D元素对应的相对分子质量最小的氢化物受热分解所需温度B D(填“>”、“<”或“=”)。
(3)检验E3+离子的方法是 。
(4)鉴别D的两种氧化物的试剂是 (仅限一种);常温常压下DO2与一氧化碳反应生成 1.6g D单质与另一种氧化物,并放出14.86kJ的热量,写出此反应的热化学方程式 。
(5)0.1mol·L-1C2D溶液中各种离子浓度从大到小的顺序是 。
(6)AO2、O2和熔融NaAO3可制作燃料电池,其原理如图所示。该电池在使用过程电极Ⅰ生成氧化物Y,写出电极Ⅱ的反应式 。

(1)第三正确第IA族 (2)>
(3)取少量的样品于试管中,滴加KSCN溶液,若溶液变红色,则含有铁离子
(4)品红溶液(或氯化钡溶液) SO2(g)+2CO(g)=S(s)+2CO2(g) △H=-297.2kJ/mol
(5)c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) (6)O2+2N2O5+4e-=4NO3-
(3)取少量的样品于试管中,滴加KSCN溶液,若溶液变红色,则含有铁离子
(4)品红溶液(或氯化钡溶液) SO2(g)+2CO(g)=S(s)+2CO2(g) △H=-297.2kJ/mol
(5)c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) (6)O2+2N2O5+4e-=4NO3-
试题分析:A最高正价与最低负价代数和为2,则A是第ⅤA族元素,且A的原子序数最小,所以A是氮元素。C单质质软,通常保存在煤油中,则C是钠元素。B与元素C可形成离子个数比为1:2和1:1的化合物,则在短周期中符合条件的是氧化钠和过氧化钠,则B是氧元素。D元素可形成两种氧化物,其中一种是形成酸雨的主要成分,因此D是硫元素。E单质是用途最广泛的金属,人体缺少该元素易患贫血症,且E不是短周期元素,所以E是铁。
(1)钠的原子序数是11,在元素周期表中的位置是第三正确第IA族。
(2)非金属性越强,氢化物的稳定性越强,氧元素的非金属性强于硫元素,则B、D元素对应的相对分子质量最小的氢化物受热分解所需温度B>D。
(3)检验铁离子的方法是取少量的样品于试管中,滴加KSCN溶液,若溶液变红色,则含有铁离子。
(4)二氧化硫能使品红溶液褪色,因此鉴别D的两种氧化物的试剂是品红溶液;常温常压下DO2与一氧化碳反应生成 1.6g D单质与另一种氧化物,并放出14.86kJ的热量,则生成32g硫放出的热量是14.86kJ×
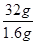 =297.2kJ,因此此反应的热化学方程式为SO2(g)+2CO(g)=S(s)+2CO2(g) △H=-297.2kJ/mol。
=297.2kJ,因此此反应的热化学方程式为SO2(g)+2CO(g)=S(s)+2CO2(g) △H=-297.2kJ/mol。(5)硫化钠溶于水,硫离子水解溶液显碱性,则0.1mol·L-1C2D溶液中各种离子浓度从大到小的顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)。
(6)根据装置图可知,氧气通入的电极应该是正极,得到电子,则电极I是负极,二氧化氮失去电子,其氧化产物Y应该是N2O5,所以根据电解质是熔融NaNO3可知电极Ⅱ的反应式是O2+2N2O5+4e-=4NO3-。

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
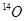 的质子数和中子数相等
的质子数和中子数相等 的空间构型是 ,其中D原子的杂化轨道类型是 。
的空间构型是 ,其中D原子的杂化轨道类型是 。
 HCl+HClO
HCl+HClO X+2WZ
X+2WZ