题目内容
9.按要求填空(1)在Fe、Fe2+、Fe3+、H+中,
①只有氧化性的是Fe3+、H+,
②只有还原性的是Fe,
③既有氧化性又有还原性的是Fe2+.
(2)某同学写出以下三个化学方程式(未配平):
①NO+HNO3-→N2O3+H2O
②NH3+NO-→HNO2+H2O
③N2O4+H2O-→HNO3+HNO2
在②、③反应中一定不可能实现的是②;在反应①中氧化剂是HNO3,还原性最强的是NO,若该物质消耗30g,转移电子1mol.
分析 (1)最高价态的元素只有氧化性,最低价态的元素只有还原性,中间价态的元素既有氧化性又有还原性,据此分析解答;
(2)根据氧化还原反应的特征是元素化合价的升降判断;得电子化合价降低的物质为氧化剂;根据还原剂的还原性大于还原产物的还原性进行判断;根据N元素的化合价变化分析.
解答 解:(1)Fe3+、H+中的化合价都是最高价态,所以都只有氧化性;
Fe中的化合价是最低价态,所以只有还原性;
Fe2+中的化合价是中间价态,所以既有氧化性又有还原性,
故答案为:Fe3+、H+; Fe;Fe2+;
(2)氧化还原反应的特征是元素化合价的升降,②中N元素化合价只升高,不符合氧化还原反应的原理;在反应①NO+HNO3-→N2O3+H2O中HNO3得电子作氧化剂;NO作还原剂,反应中NO的还原性最强,消耗30gNO时,n(NO)=$\frac{m}{M}$=$\frac{30g}{30g/mol}$=1mol,NO中N元素的化合价从+2价升到+3价,则转移1mol电子;
故答案为:②;HNO3;NO;1.
点评 本题综合考查氧化还原反应,侧重于学生的分析能力的考查,明确元素化合价与氧化性和还原性的关系是解本题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.设NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,VL CHCl3含有的碳原子数为$\frac{V}{22.4}$NA | |
| B. | 常温常压下,1mol乙基所含的电子总数为17NA | |
| C. | 12g C60中含有60NA个电子 | |
| D. | 1mol HNO3见光分解,转移电子数为4NA |
17.(双选)下列化学反应中电子转移的表示方法正确的是( )
| A. | 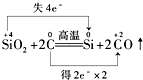 | |
| B. |  | |
| C. |  | |
| D. |  |
14.在2L容器中发生3A+B═2C的反应,最初加入的A、B都是4mol,A的反应速率为0.12mol/(L•s),10s后容器内的总物质的量为( )
| A. | 1.6 mol | B. | 2.8 mol | C. | 6.4 mol | D. | 3.6 mol |
1.对于反应Br2+SO2+2H2O=2HBr+H2SO4和2HBr+H2SO4(浓)=Br2+SO2↑+2H2O,下列说法中正确的是( )
| A. | 氧化性浓H2SO4>Br2,还原性:SO2>HBr | |
| B. | 它们互为可逆反应 | |
| C. | 反应条件的改变引起了反应方向的改变,它们都符合事实 | |
| D. | 它们相互矛盾,不可能符合事实 |
18.下列说法正确的是( )
| A. | 水溶液中,1mol KCl和1mol KClO3电离出的氯离子一样多 | |
| B. | 电解质NaHCO3的电离方程式为:NaHCO3═Na++HCO3- | |
| C. | 凡溶于水后能电离出氢离子的化合物都是酸 | |
| D. | 氯化钠溶液在电流作用下,电离成自由移动的钠离子和氯离子 |
19.填写下表:
| 微粒符号 | 质子数 | 中子数 | 电子数 | 质量数 |
| ${\;}_{19}^{40}$K | 19 | 21 | 19 | 40 |
| ${\;}_{18}^{38}$Ar | 18 | 20 | 19 | 38 |
| ${\;}_{16}^{32}$S2- | 16 | 16 | 18 | 32 |