题目内容
1.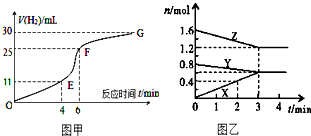 化学反应速率和限度是中学化学原理中很重要部分,根据所学知识回答下列问题:
化学反应速率和限度是中学化学原理中很重要部分,根据所学知识回答下列问题:I.用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
(1)实验过程如图甲所示,分析判断EF段化学反应速率最快.
(2)将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其影响因素是温度,一定时间后反应速率逐渐减慢,其原因是随着反应的进行,浓度逐渐减小,浓度因素大于温度因素.
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是ACE
A.蒸馏水 B.氯化钠固体 C.氯化钠溶液 D.浓盐酸 E.降低温度
Ⅱ.某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图乙所示.由图中数据分析:
(1)该反应的化学方程式:Y+2Z?3X;
(2)反应开始至2min末,X的反应速率为0.1(mol•L-1•min-1);
(3)3min后图中曲线所表示的含义是在此条件下该反应已达到反应限度(或化学平衡).
分析 Ⅰ、(1)根据图象判断,反应速率越大,斜率越大;
(2)开始时反应物浓度最大,且反应放热,温度逐渐升高,随着反应的进行,浓度逐渐减小;
(3)减缓反应速率,可降低氢离子浓度以及反应温度等;
Ⅱ、(1)根据参加反应的物质的物质的量之比等于化学计量数之比书写化学方程式;
(2)根据v=$\frac{△c}{△t}$计算;
(3)从曲线的变化特点分析.
解答 解:Ⅰ、(1)由图象可知反应速率越大,斜率越大,则EF段反应速率最大,故答案为:EF;
(2)开始时反应物浓度最大,随着反应的进行浓度降低,但反应放热,温度逐渐升高,所以反应速率逐渐增大,随着反应的进行,浓度逐渐减小,浓度因素大于温度因素,反应速率逐渐减小,
故答案为:温度;随着反应的进行,浓度逐渐减小,浓度因素大于温度因素;
(3)A.加入蒸馏水,反应速率减小,故A正确;
B.加入氯化钠固体,浓度不变,反应速率不变,故B错误;
C.加入氯化钠溶液,浓度减小,反应速率减小,故C正确;
D.加入浓盐酸,氢离子浓度增大,反应速率增大,故D错误;
E.降低温度,反应速率减小,故E正确.
故答案为:ACE;
Ⅱ、(1)由图象可以看出,反应中Z、Y的物质的量减少,应为反应物,X的物质的量增多,应为生成物,
当反应进行到3min时,△n(Y)=0.2mol,△n(Z)=0.4mol,△n(X)=0.6mol,
则△n(Y):△n(Z):△n(X)=1:2:3,参加反应的物质的物质的量之比等于化学计量数之比,
则反应的方程式为:Y+2Z?3X,故答案为:Y+2Z?3X;
(2)反应开始至2min末,X的反应速率为:v=$\frac{△c}{△t}$=$\frac{\frac{0.6mol}{2L}}{3min}$=0.1mol/(L•min),故答案为:0.1;
(3)3min后,各物质的物质的量不再发生变化,说明反应达到反应限度,故答案为:在此条件下该反应已达到反应限度(或化学平衡).
点评 本题考查化学反应速率的影响因素、化学平衡图象问题,侧重于学生的分析能力和基础知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大,注意把握影响化学反应速率的因素与影响原因的关系.

| A. | HCl→Cl2→HClO→NaClO | B. | Na→Na2O2→Na2CO3→NaHCO3 | ||
| C. | Mg→MgO→Mg(OH)2→MgCl2 | D. | Na→NaOH→NaHCO3→Na2CO3 |
| A. | 乙烷和丙烯的混合物共1mol,完成燃烧后不能确定生成的水的物质的量 | |
| B. | 等质量的乙炔和苯乙烯,完成燃烧后不能确定耗氧量是否相同 | |
| C. | 间二溴苯仅有一种空间结构,不能说明苯中不存在单双键交替的结构 | |
| D. | 用氢氧化钠溶液不能区别植物油和矿物油 |
| A. | 化合反应 | B. | 分解反应 | C. | 复分解反应 | D. | 置换反应 |
| 化学键 | Cl-Cl | H-H | H-Cl | C-Cl | C-F | Si-Si | Si-O |
| 键能/kJ.mol-1 | 243 | 436 | 432 | 330 | 427 | 176 | 460 |
| A. | CCl4的稳定性小于CF4的稳定性 | |
| B. | CH4(g)跟Cl2(g)反应生成HCl(g)和CCl4(g)的反应是吸热反应 | |
| C. | 晶体硅的熔点低于SiO2 | |
| D. | 4 g H2和足量Cl2反应放出的热量为370 kJ/mol |
| A. | 逐渐变浅 | B. | 变深绿色 | C. | 变棕黄色 | D. | 没有变化 |
①冰雹 ②潮汐③酸雨④地震 ⑤臭氧层空洞⑥火山爆发 ⑦大脖子病 ⑧全球性气候变暖.
| A. | ③⑤⑧ | B. | ②③⑤⑥ | C. | ①③⑤⑦ | D. | ②③④⑦ |