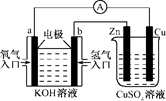
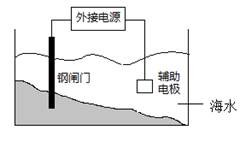
题目内容
铅蓄电池的总反应式为:PbO2+Pb+2H2SO4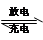 2PbSO4+2H2O,根据此反应判断下列叙述中正确的是
2PbSO4+2H2O,根据此反应判断下列叙述中正确的是

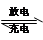 2PbSO4+2H2O,根据此反应判断下列叙述中正确的是
2PbSO4+2H2O,根据此反应判断下列叙述中正确的是
| A.放电时,H2SO4浓度降低 |
| B.充电时,电源正极与蓄电池的“—”极连接 |
| C.负极的电极反应式为:Pb+SO42--2e-=PbSO4 |
| D.因PbSO4难溶,铅蓄电池报废后无需回收处理 |
AC
根据总反应式可知,放电时消耗硫酸,所以硫酸的浓度降低,A正确;充电时,电源正极与蓄电池的“+”极连接,B不正确;原电池中负极失去电子,所以C正确;硫酸铅是重金属盐,随意丢弃铅蓄电池,容易导致环境的污染,D不正确,答案选AC。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 2PbSO4+2H2O
2PbSO4+2H2O
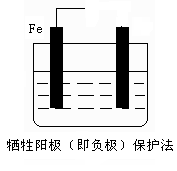
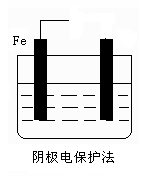
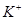 通过,该电池放电时的化学方程式为:
通过,该电池放电时的化学方程式为: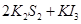 ?=
?=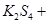 3KI。装置(Ⅱ)为电解示意图,当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是?( )
3KI。装置(Ⅱ)为电解示意图,当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是?( ) 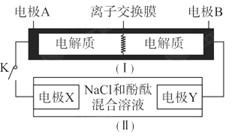
 =
=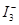
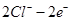 =
=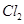 ↑
↑