题目内容
(8分)铅蓄电池是最常见的二次电池,它是由两组平行排列的栅状铅合金极板作为主架,正极板上覆盖PbO2,负极板上覆盖Pb,电解质是硫酸。电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题:
(1)放电时:正极的电极反应式是__________________________;电解液中H2SO4的浓度将变____________;当外电路通过1 mol电子时,理论上负极板的质量增加______________g。
(2)在完全放电耗尽PbO2和Pb时,若按下图连接,电解一段时间后,则在A电极上生成____________、在B电极上生成____________,此时铅蓄电池的正负极的极性将____ _____。
Pb+PbO2+4H++2SO42-
 2PbSO4+2H2O
2PbSO4+2H2O请回答下列问题:
(1)放电时:正极的电极反应式是__________________________;电解液中H2SO4的浓度将变____________;当外电路通过1 mol电子时,理论上负极板的质量增加______________g。
(2)在完全放电耗尽PbO2和Pb时,若按下图连接,电解一段时间后,则在A电极上生成____________、在B电极上生成____________,此时铅蓄电池的正负极的极性将____ _____。

(1)PbO2 + 4H+ + SO42- + 2e-= PbSO4 + 2H2O (2分)小(1分) 48(2分)
(2)Pb PbO2 对换(各1分)
(2)Pb PbO2 对换(各1分)
(1)放电相当于原电池,正极是得到电子的。所以根据总的方程式可知,正极反应式是PbO2 + 4H+ + SO42- + 2e-= PbSO4 + 2H2O。根据总反应的方程式可知,放电是消耗硫酸的,因此硫酸的浓度是降低的;负极方程式是Pb+ SO42-- 2e-= PbSO4,所以外电路通过1 mol电子时,理论上负极板的质量增加0.5mol×96g/mol=48g。
(2)根据装置图可知,铅和电源的正极相连,作阳极,失去电子。而二氧化铅和电源的负极相连,作阴极,得到电子。所以A电极上生铅,B电极生成二氧化铅,因此此时铅蓄电池的正负极的极性将对换。
(2)根据装置图可知,铅和电源的正极相连,作阳极,失去电子。而二氧化铅和电源的负极相连,作阴极,得到电子。所以A电极上生铅,B电极生成二氧化铅,因此此时铅蓄电池的正负极的极性将对换。

练习册系列答案
相关题目
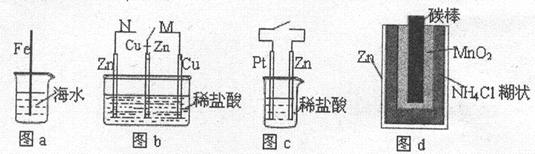
 的移动方向为由里向外
的移动方向为由里向外
 2PbSO4+2H2O,根据此反应判断下列叙述中正确的是
2PbSO4+2H2O,根据此反应判断下列叙述中正确的是
 R2Cu+2H+。则萃取和反萃取进行的程度受 和 的影响。
R2Cu+2H+。则萃取和反萃取进行的程度受 和 的影响。