题目内容
【题目】下图所示各物质是由1~20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出。已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于泳池消毒。反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。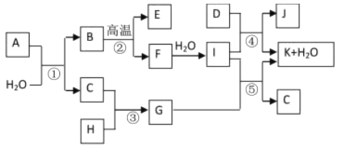
请回答下列问题:
(1)I中所含化学键类型_______________,
(2)G的水溶液呈酸性,用离子方程式表示其原因_______________________
(3)实验室制备气体C的化学方程式___________________________________________
(4)已知含7.4gI的稀溶液与200mL1mol/L的H溶液反应放出11.56kJ的热量,写出该反应的热化学方程式____________________________________________________
(5)物质A由三种元素组成,1 mol A与水反应可生成1 mol B和2 mol C,A化学式为_______________。
【答案】 离子键 共价键 NH4+ + H2O![]() NH3·H2O + H+ Ca(OH)2+2 NH4Cl
NH3·H2O + H+ Ca(OH)2+2 NH4Cl![]() CaCl2+2NH3↑+2H2O Ca(OH)2(aq)+2HCl(aq)=CaCl2(aq)+2H2O(l) △H=-115.6kJ/mol CaCN2
CaCl2+2NH3↑+2H2O Ca(OH)2(aq)+2HCl(aq)=CaCl2(aq)+2H2O(l) △H=-115.6kJ/mol CaCN2
【解析】题中各物质都是由1~20号元素中部分元素组成的单质或其化合物,结合已知和流程,D是一种黄绿色的气体单质,则D是Cl2;物质J可用于泳池消毒,则J是Ca(ClO)2,所以K是CaCl2、I是Ca(OH)2;F和水反应生成I,则F是CaO;B高温生成E和F,则E为CO2、B是CaCO3;C、H是无色有刺激性气味的气体,且反应生成G,G和I[Ca(OH)2]反应生成K(CaCl2)、H2O和C,则G中含有氯元素,所以G是NH4Cl、C是NH3、H是HCl。
(1)I是Ca(OH)2,钠离子与氢氧根离子之间是离子键,氢氧根离子中H与O之间是共价键,故所含化学键类型为:离子键和共价键。
(2)G是NH4Cl,属于强酸弱碱盐,NH4+水解使溶液显酸性,离子方程式为:NH4++H2O![]() NH3H2O+H+。
NH3H2O+H+。
(3)C是NH3,实验室常用Ca(OH)2和NH4Cl固体在加热条件下制取氨气,化学方程式为:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
(4)I是Ca(OH)2,7.4gCa(OH)2的物质的量是:7.4g÷74gmol-1=0.1mol;H是HCl,200mL1mol/L的HCl溶液中溶质的物质的量是:0.2L×1mol/L=0.2mol,0.1molCa(OH)2与0.2molHCl恰好完全反应放出11.56kJ的热量,所以该反应的热化学方程式为:Ca(OH)2(aq)+2HCl(aq)=CaCl2(aq)+2H2O(l) △H=-115.6kJ/mol。
(5)已知物质A由三种元素组成,1molA与水反应可生成1molB和2molC,该反应可表示为:A+H2O→CaCO3+2NH3,则A中应含有Ca、C、N三种元素,根据O原子守恒可得H2O的化学计量数为3,所以A的化学式为CaCN2。

【题目】葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
水中的溶解性 | 可溶于冷水,易溶于热水 | 可溶 | 易溶 | 易溶 |
乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
实验流程如下:
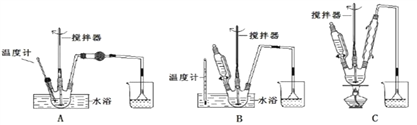
请回答下列问题:(1)第①步中溴水氧化葡萄糖时,下列装置最合适的是________。
制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是________。
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是________;本实验中不宜用CaCl2替代CaCO3,理由是________。
(3)第③步需趁热过滤,其原因是________。
(4)第④步加入乙醇的作用是________。
第⑥步中,下列洗涤剂最合适的是________。
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液


