题目内容
12.A、B为同周期元素,如果A原子半径比B原子半径大,则下列判断中正确的是( )| A. | A、B 两元素形成的最高价氧化物对应水化物的酸性应:A强于B | |
| B. | A的气态氢化物比B的气态氢化物稳定 | |
| C. | A的原子序数一定小于B的原子序数 | |
| D. | A的阴离子比B的阴离子还原性弱 |
分析 A、非金属性越强,最高价氧化物对应水化物的酸性越强;
B、非金属性越强,气态氢化物越稳定,;
C、同周期从左到右随着原子序数增大,原子半径减小;
D、非金属性越强,对应离子的还原性越弱.
解答 解:A、同周期从左到右,原子半径减小,非金属性增强,所以两元素形成的最高价氧化物水化物的酸性A强于B,说明A的非金属性强于B,A的原子半径小于B,故A错误;
B、A的气态氢化物比B的气态氢化物稳定,说明A的非金属性强于B,A的原子半径小于B,故B错误;
C、同周期从左到右随着原子序数增大,原子半径减小,A原子半径比B大,则A的原子序数一定小于B的原子序数,故C正确;
D、A的阴离子比B的阴离子还原性弱,说明A的非金属性比B强,A的原子半径小于B,故D错误;
故选C.
点评 本题考查了元素周期律,侧重于同周期元素性质递变规律的考查,注意元素周期表中的特殊元素结构和性质的特殊性,题目难度不大.

练习册系列答案
相关题目
2.下列分散系中,分散质不能通过滤纸的是( )
| A. | 食盐水 | B. | 泥水 | C. | Fe(OH)3胶体 | D. | 硫酸铜溶液 |
3.有两包白色固体A和B,可能由CuSO4、Na2SO4、Na2CO3、Ba(NO3)2、NaCl 中的一种或几种组成.为了判断其中的成份,某进行了如下实验,实验现象分别如下表所示,请你帮助他对这些现象作一些判断:
(1)对白色固体A的实验
(2)对白色固体B的实验
(1)对白色固体A的实验
| 实验步骤 | 实验现象 | 实验结论及分析 |
| 取固体溶于水 | 得到蓝色溶液 | ①一定含有CuSO4、NaCl; ②可能含有Na2SO4; ③加入足量Ba(NO3)2溶液的目的是将SO42-沉淀完全(防止干扰Cl-检验); 不利用其他试剂,检验Ba(NO3)2已经过量的方法是静置,向上层清液中继续滴加Ba(NO3)2溶液,无新沉淀生成. |
| 向溶液中加入足量Ba(NO3)2溶液 | 得到白色沉淀 | |
| 过滤,向滤液再加入AgNO3溶液 | 得到白色沉淀 |
| 实验步骤 | 实验现象 | 实验结论及分析 |
| 取固体溶于水 | 得到白色沉淀,静置后溶液为无色 | ①一定不含有CuSO4; ②可能含有NaCl. |
| 过滤,向所得沉淀中加入足量盐酸 | 沉淀部分溶解,有气泡放出 |
7.肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和水蒸气.已知:
N2(g)+2O2(g)=N2O4(g)△H=+8.7kJ•mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1
下列表示肼跟N2O4反应的热化学方程式,正确的是( )
N2(g)+2O2(g)=N2O4(g)△H=+8.7kJ•mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1
下列表示肼跟N2O4反应的热化学方程式,正确的是( )
| A. | 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-542.7 kJ•mol-1 | |
| B. | 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1059.3 kJ•mol-1 | |
| C. | N2H4(g)+$\frac{1}{2}$N2O4(g)=$\frac{3}{2}$N2(g)+2H2O(g)△H=-1076.7 kJ•mol-1 | |
| D. | 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1076.7 kJ•mol-1 |
2.苯甲酸是一种化工原料,常用作制药和染料的中间体,也用于制取增塑剂和香料等.实验室合成苯甲酸的原理、有关数据及装置示意图如下:反应过程: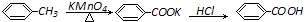
反应试剂、产物、副产物的物理常数:
注释:[1]100℃左右开始升华.
[2]苯甲酸在100g水中的溶解度为4℃,0.18g;18℃,0.27g;75℃,2.2g.
按下列合成步骤回答问题:
Ⅰ.苯甲酸制备:按如图在250mL三颈瓶中放入2.7mL,甲苯和100mL水,控制100℃机械搅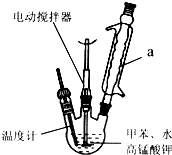 拌溶液,在石棉网上加热至沸腾.
拌溶液,在石棉网上加热至沸腾.
分批加入8.5g高锰酸钾,继续搅拌约需4~5h,静置发现不再出现分层现象时,停止反应.装置a的作用是将甲苯和水冷凝回流,防止甲苯的挥发而降低产品产率.
写出并配平该反应化学方程式:
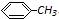 +2KMnO4 $\stackrel{△}{→}$
+2KMnO4 $\stackrel{△}{→}$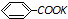 +2 MnO2↓+H2O+1KOH
+2 MnO2↓+H2O+1KOH
Ⅱ.分离提纯:
(1)除杂.将反应混合物加入一定量亚硫酸氢钠溶液充分反应,此时反应离子方程式为:OH-+HSO3-=SO32-+H2O、2MnO4-+3SO32-+H2O=2MnO2↓+3SO42-+2OH-.还可用乙二酸或者乙二酸钠有机化合物代替亚硫酸氢钠(填写名称).
(2)过滤洗涤.其目的是除去二氧化锰并回收二氧化锰表面附着的产品.
(3)苯甲酸生成.合并实验(2)滤液和洗涤液,放在冰水浴中冷却,然后用浓盐酸酸化,至苯甲酸全部析出.将析出的苯甲酸减压过滤,得到滤液A和沉淀物B.沉淀物B用少量冷水洗涤,挤压去水分,把制得的苯甲酸放在沸水浴上干燥,得到粗产品C.
(4)粗产品提纯.将粗产品C进一步提纯,可用下列BD操作(填入正确选项前的字母).
A.萃取分液 B.重结晶 C.蒸馏 D.升华
Ⅲ.产品纯度测定:称取1.220g产品,配成100mL乙醇溶液,移取25.00mL溶液于锥形瓶,滴加2~3滴酚酞;(填写“甲基橙”或“酚酞”).然后用标准浓度KOH溶液滴定,消耗KOH溶质的物质的量为2.40×10-3mol.产品中苯甲酸质量分数的计算表达式为$\frac{2.40×1{0}^{-3}×122×4}{1.22}$,计算结果为96.00%(保留两位有效数字).
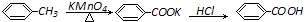
反应试剂、产物、副产物的物理常数:
| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 溶解度(g) | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.4[1] | 248 | 1.2659 | 微溶[2] | 易溶 |
[2]苯甲酸在100g水中的溶解度为4℃,0.18g;18℃,0.27g;75℃,2.2g.
按下列合成步骤回答问题:
Ⅰ.苯甲酸制备:按如图在250mL三颈瓶中放入2.7mL,甲苯和100mL水,控制100℃机械搅
 拌溶液,在石棉网上加热至沸腾.
拌溶液,在石棉网上加热至沸腾.分批加入8.5g高锰酸钾,继续搅拌约需4~5h,静置发现不再出现分层现象时,停止反应.装置a的作用是将甲苯和水冷凝回流,防止甲苯的挥发而降低产品产率.
写出并配平该反应化学方程式:
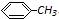 +2KMnO4 $\stackrel{△}{→}$
+2KMnO4 $\stackrel{△}{→}$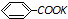 +2 MnO2↓+H2O+1KOH
+2 MnO2↓+H2O+1KOHⅡ.分离提纯:
(1)除杂.将反应混合物加入一定量亚硫酸氢钠溶液充分反应,此时反应离子方程式为:OH-+HSO3-=SO32-+H2O、2MnO4-+3SO32-+H2O=2MnO2↓+3SO42-+2OH-.还可用乙二酸或者乙二酸钠有机化合物代替亚硫酸氢钠(填写名称).
(2)过滤洗涤.其目的是除去二氧化锰并回收二氧化锰表面附着的产品.
(3)苯甲酸生成.合并实验(2)滤液和洗涤液,放在冰水浴中冷却,然后用浓盐酸酸化,至苯甲酸全部析出.将析出的苯甲酸减压过滤,得到滤液A和沉淀物B.沉淀物B用少量冷水洗涤,挤压去水分,把制得的苯甲酸放在沸水浴上干燥,得到粗产品C.
(4)粗产品提纯.将粗产品C进一步提纯,可用下列BD操作(填入正确选项前的字母).
A.萃取分液 B.重结晶 C.蒸馏 D.升华
Ⅲ.产品纯度测定:称取1.220g产品,配成100mL乙醇溶液,移取25.00mL溶液于锥形瓶,滴加2~3滴酚酞;(填写“甲基橙”或“酚酞”).然后用标准浓度KOH溶液滴定,消耗KOH溶质的物质的量为2.40×10-3mol.产品中苯甲酸质量分数的计算表达式为$\frac{2.40×1{0}^{-3}×122×4}{1.22}$,计算结果为96.00%(保留两位有效数字).
9.室温下,体积为2L的密闭容器中A,B,C三种气体的起始浓度和平衡浓度如下表:
下列说法中正确的是( )
| 物质 | A | B | C |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 发生的反应可表示为A+3B?2C | |
| B. | 反应达到平衡时B的转化率为25% | |
| C. | 若起始时密闭容器中0.1molA,0.1molB,0.2molC时,反应达到平衡时,c(A)=0.05mol•L-1 | |
| D. | 改变起始时容器中各气体的物质的量,可以改变此反应的平衡常数 |
7.能正确表示蛋白质分子由简到繁的结构层次的一组数字是( )
①氨基酸
②C、H、O、N等元素
③氨基酸分子相互结合
④多肽
⑤形成一定的空间结构.
①氨基酸
②C、H、O、N等元素
③氨基酸分子相互结合
④多肽
⑤形成一定的空间结构.
| A. | ①②③④⑤ | B. | ②①③④⑤ | C. | ②①③⑤④ | D. | ②①④③⑤ |