题目内容
9.煤粉中的氮元素在使用过程中的转化关系如图所示:
(1)②中NH3参与反应的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(2)③中加入的物质可以是bd(填字母序号).
a.空气 b.CO c.KNO3 d.NH3
(3)焦炭氮中有一种常见的含氮有机物吡啶(
 ),其分子中相邻的C和N原子相比,N原子吸引电子能力更强(填“强”或“弱”),从原子结构角度解释原因:C和N在周期表的位置是同一周期从左到右,N 的原子半径更小,原子核对外层电子的吸引力更强.
),其分子中相邻的C和N原子相比,N原子吸引电子能力更强(填“强”或“弱”),从原子结构角度解释原因:C和N在周期表的位置是同一周期从左到右,N 的原子半径更小,原子核对外层电子的吸引力更强.
分析 (1)氨气在催化剂条件下与氧气反应生成一氧化氮和水;
(2)由图表可知,氮由+2价变成0价,应加还原剂;
(3)N的电负极强,所以N原子吸引电子能力更强,C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强;.
解答 解:(1)氨气在催化剂条件下与氧气反应生成一氧化氮和水,为重要的工业反应,反应的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(2)氮由+2价变成0价,应加还原剂,选项中可以作还原剂的为CO和氨气,
故答案为:bd;
(3)N的电负极强,所以N原子吸引电子能力更强,由于C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强,故答案为:强;C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强.
点评 本题考查较为综合,涉及氨气的制备、性质以及氮氧化物的性质,侧重于基础知识的考查,题目较为简单,注意相关基础知识的学习与积累.

练习册系列答案
相关题目
19.区分氯化铁溶液和氢氧化铁胶体的实验方法是( )
| A. | 布朗运动 | B. | 电泳 | C. | 胶体聚沉 | D. | 丁达尔效应 |
17.燃料电池是燃料(如CO、H2、CH4)等跟O2(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱(如KOH)溶液,下列关于甲烷燃料电池的说法中不正确的是( )
| A. | 通入氧气的一极发生还原反应,通入甲烷的一极发生氧化反应 | |
| B. | 负极的电极反应式为CH4+10OH--8e-═CO${\;}_{3}^{2-}$+7H2O | |
| C. | 随着反应的进行,电解质溶液的pH保持不变 | |
| D. | 甲烷燃料电池的能量利用率比甲烷燃烧的大 |
4.用惰性电极电解下列溶液,电解一段时间后,电解液的pH增大了的是( )
| A. | H2SO4 | B. | KOH | C. | AgNO3 | D. | Na2SO4 |
1.下列变化或过程属于化学变化的是( )
| A. | 激光法蒸发石墨得C60 | B. | 丁达尔效应 | ||
| C. | 紫色石蕊试液通过活性炭变成无色 | D. | 用铂丝蘸取NaCl溶液进行焰色反应 |
18.工业上可用如图装置测定黄铁矿(主要成分为FeS2)中硫的质量分数(忽略SO2、H2SO3与氧气的反应)
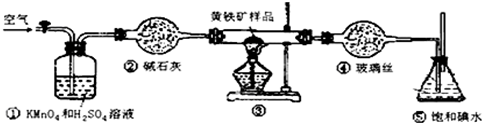
实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用200mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O═2HI+H2SO4
G.吸收液用CCl4萃取
H.取20.00mL吸收液,用标准0.2000mol•L-1的NaOH溶液滴定.
试回答:
(1)写出装置③中发生反应的化学方程式4FeS2+11O2 $\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2.
(2)步骤G中所用主要仪器是分液漏斗,应取上(填“上”或“下”)层溶液进行后续实验.
(3)装置①的作用是除去空气中的还原性气体,提高实验的准确率.
(4)步骤H中滴定时应选用酚酞作指示剂,可以根据滴入最后一滴NaOH溶液后,溶液变为浅红色,并在半分钟内不褪色现象来判断滴定已经达到终点.
(5)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收.滴定得到的数据如表所示:
则硫铁矿样品中硫元素的质量分数为16.0%(保留小数点后1位)
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂D.
A.硝酸银溶液 B.氯化钙溶液 C.澄清石灰水 D.氯化钡溶液.

实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用200mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O═2HI+H2SO4
G.吸收液用CCl4萃取
H.取20.00mL吸收液,用标准0.2000mol•L-1的NaOH溶液滴定.
试回答:
(1)写出装置③中发生反应的化学方程式4FeS2+11O2 $\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2.
(2)步骤G中所用主要仪器是分液漏斗,应取上(填“上”或“下”)层溶液进行后续实验.
(3)装置①的作用是除去空气中的还原性气体,提高实验的准确率.
(4)步骤H中滴定时应选用酚酞作指示剂,可以根据滴入最后一滴NaOH溶液后,溶液变为浅红色,并在半分钟内不褪色现象来判断滴定已经达到终点.
(5)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收.滴定得到的数据如表所示:
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.98 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂D.
A.硝酸银溶液 B.氯化钙溶液 C.澄清石灰水 D.氯化钡溶液.
19.下列化合物中,属于非电解质的是( )
| A. | CH3COOH | B. | HCl | C. | CaO | D. | CO2 |