题目内容
【题目】金属氮化物具有高熔点、高硬度、高化学稳定性以及良好的导热、导电性,目前已经广泛应用于磁学、电子工业 、耐高温结构陶瓷等领域 。回答下列问题
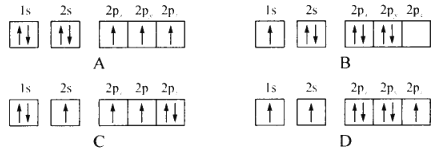
(1)下列不同状态的氮原子其能量最高的是________(填字母),基态氮原子处于最高能级的电子其电子云轮廓图形状为________
(2)第一电离能I1(N)______(填“> ”“< ”或“=”)I1(P),其原因是_____________。
(3)A和B两种金属的含氮化合物的结构如图所示:
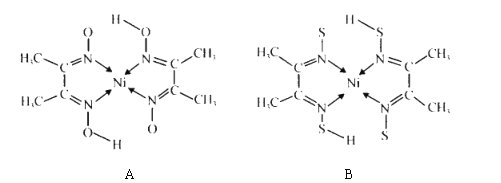
①基态 Ni 原子的核外电子排布式为[ Ar]________________。
②物质A 中碳原子的杂化方式为__________________。
③A的熔点高于 B 的,具主要原因是_______。
④B中含有的化学键类型有_____________(填字母)。
a.金属键 b. σ建
c.π键 d. 配位键
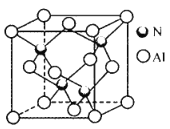
(4)氮化铝晶胞如图所示。氮原子的配位数为_______,每个铝原子周围紧邻__________个铝原子;已知立方氮化铝晶体密度为ρg cm-3,晶胞中最近的两个铝原子之间的距离为___pm(列出计算式即可,阿伏加德罗常数为6. 02×1023mol -1)。
【答案】D 哑铃形 > N的原子半径比P的小,原子核对最外层电子的吸引力较大 3d84s2 sp3、sp2 物质A分子间存在氢键 bcd 4 12 ![]() ×
×![]() ×1010
×1010
【解析】
(1)基态氮原子的核外电子排布式为1s22s2 2p3,离核越远的电子能量越高,处于2p能级的电子量最高;
(2)N和P位于同主族,半径越小,原子核对最外层电子的吸引力较大,则第一电离能更大;
(3)①基态Ni原子的核外电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2;
②物质A 中碳原子有两种一种为甲基上的碳,类似于甲烷的四面体结构,另一种为C=N上的碳原子,结合碳原子的空间构型分析判断杂化类型;
③物质A、B结构相似,晶体类型相同,A中含有氢键,据此分析解答;
④根据B的结构图,B中含有配位键和共价键,配位键和共价单键都为σ键,双键中含有一个σ键和一个π键;
(4)由氮化铝晶胞图示中原子间位置关系判断配位数,该晶胞中Al原子位于晶胞的顶点和面心,则晶胞中Al原子的数目为8×![]() +6×
+6×![]() =4,N原子位于晶胞的内部,则N原子的数目为4,则晶胞的质量为
=4,N原子位于晶胞的内部,则N原子的数目为4,则晶胞的质量为![]() g,根据m=ρV计算晶胞的边长,晶胞中最近的两个铝原子之间的距离为晶胞面对角线长度的一半,据此计算解答。
g,根据m=ρV计算晶胞的边长,晶胞中最近的两个铝原子之间的距离为晶胞面对角线长度的一半,据此计算解答。
(1)氮原子其能量最高的是D,基态氮原子的核外电子排布式为1s22s2 2p3,离核越远的电子能量越高,处于2p能级的电子量最高,其电子云轮廓图形状为哑铃形;
(2)N和P位于同主族,N的原子半径比P的小,原子核对最外层电子的吸引力较大,则第一电离能I1(N)>I1(P);
(3)①基态Ni原子的核外电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2;
②物质A 中碳原子有两种一种为甲基上的碳,类似于甲烷的四面体结构,该碳原子为sp3杂化,另一种为C=N上的碳原子,C=N是平面结构,则该碳原子为sp2杂化;
③物质A中的氧原子可形成分子间存在氢键,B中不能形成氢键,则A的熔点高于 B;
④根据B的结构图,B中含有配位键和共价键,配位键和共价单键都为σ键,双键中含有一个σ键和一个π键,只有金属晶体中含有金属键,则B中含有的化学键类型有σ键、π键、配位键,答案选bcd;
(4)由氮化铝晶胞图示可知,氮原子的配位数为4,每个铝原子周围紧邻12个铝原子;该晶胞中Al原子位于晶胞的顶点和面心,则晶胞中Al原子的数目为8×![]() +6×
+6×![]() =4,N原子位于晶胞的内部,则N原子的数目为4,则晶胞的质量为
=4,N原子位于晶胞的内部,则N原子的数目为4,则晶胞的质量为![]() g,根据m=ρV可得,晶胞的边长=
g,根据m=ρV可得,晶胞的边长= cm,晶胞中面对角线的长度为
cm,晶胞中面对角线的长度为![]() ×
× cm,晶胞中最近的两个铝原子之间的距离为晶胞面对角线长度的一半,则晶胞中最近的两个铝原子之间的距离为
cm,晶胞中最近的两个铝原子之间的距离为晶胞面对角线长度的一半,则晶胞中最近的两个铝原子之间的距离为![]() ×
× cm=
cm=![]() ×
×![]() ×1010 pm。
×1010 pm。