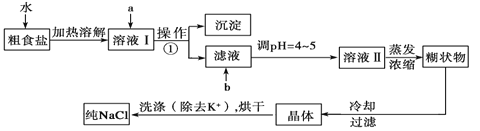
题目内容
【题目】(1)甲醇(CH3OH)是一种重要的化工原料。已知
CH3OH(1) + O2(g) = CO(g) + 2H2O(g) ; △H = -443.64 kJ·mol-1
2CO (g) + O2(g) = 2CO2(g) ; △H =-566.00 kJ·mol-1
H2O(1) = H2O (g) ; △H = + 44.00 kJ·mol-1
①试写出能表示CH3OH(1)燃烧热的热化学方程式: 。试利用热化学方程式计算,完全燃烧16g甲醇生成CO2和H2O(l)时,放出的热量为 kJ
②科研人员新近开发出一种由甲醇和氧气以强碱做电解质溶液的新型手机电池。据此回答下列问题:氧气在 极反应;通入甲醇的电极反应式为_________________
(2)如图所示,800℃时A、B、C三种气体在密闭容器中反应时的浓度变化,分析图像,回答问题: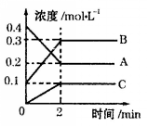
①该反应的方程式为 。
②2min内,用B表示的反应速率为 。
③在其他条件下,测得A的反应速率为0.05mol/(L·s),此时的反应与800℃时相比, 。
A.比800℃时快 B.比800℃时慢
C.和800℃时速率一样 D.无法比较
【答案】(1) ①CH3OH(1) +3/2O2(g) = CO2(g) + 2H2O
(1)△H =-814.64kJ·mol-1 ,407.32;② 正,CH3OH + 8OH--6e-= CO32-+ 6H2O;
(2)① 2A![]() 2B+C;② 0.1mol /(L·min) ;③ A。
2B+C;② 0.1mol /(L·min) ;③ A。
【解析】
试题分析:(1)CH3OH(l) + O2(g)=CO(g) + 2H2O(g) △H=-443.64kJ·mol-1 ①;2CO(g) + O2(g)=2CO2(g) △H=-566.00kJ·mol-1 ②;H2O(l)=H2O(g) △H= + 44.00kJ·mol-1 ③,(①×2 + ②-③×4)/2,得出:CH3OH(l) + 3/2O2(g)=CO2(g) + 2H2O(l) △H=-814.64kJ·mol-1,消耗16g甲醇燃烧放出的热量为814.64×16/32kJ=407.32kJ;②根据原电池的原理,氧气应在正极上反应,O2 + 2H2O + 4e-=4OH-,负极:CH3OH + 8OH--6e-=CO32- + 6H2O;(2)B、C为生成物,A为反应物,根据化学反应速率之比等于化学计量数之比,因此有A:B:C=(0.4-0.2):(0.3-0.1):0.1=2:2:1,因此反应方程式为:2A![]() 2B+C②根据化学反应速率的定义,v(A)=v(B)=0.2/2mol/(L·min)=0.1 mol/(L·min);③v(A)=0.05mol/(L·s)=0.05×60 mol/(L·min)=3 mol/(L·min),比800℃快,故选项A正确。
2B+C②根据化学反应速率的定义,v(A)=v(B)=0.2/2mol/(L·min)=0.1 mol/(L·min);③v(A)=0.05mol/(L·s)=0.05×60 mol/(L·min)=3 mol/(L·min),比800℃快,故选项A正确。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案