题目内容
【题目】粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
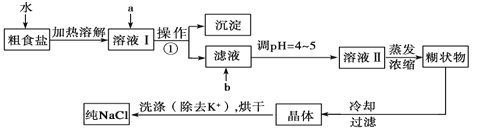
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳、稀盐酸。
(1)欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-,选出a所代表的试剂,按滴加顺序依次为___________(只填化学式)。
(2)如何检验SO42-是否沉淀完全_____________。
(3)调节pH的目的是_____________,试剂b是________(填名称)。
(4)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为______________,使用该试剂的目的是除去晶体表面的杂质,减少晶体的损耗。
【答案】
(1)BaCl2、NaOH、Na2CO3(或NaOH、BaCl2、Na2CO3或BaCl2、Na2CO3、NaOH);
(2)静置,向少量上层清液中(或取少量上层清液)继续滴加BaCl2溶液,无沉淀产生,说明已沉淀完全,反之,则未沉淀完全。
(3)中和溶液中过量的OH- 和CO32-,稀盐酸;
(4)75%乙醇
【解析】
试题分析:(1)除去粗盐中的可溶性杂质:Ca2+、Mg2+、Fe3+、SO42-时,可以加入过量NaOH(去除镁离子和铁离子):Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓;加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3,碳酸钠必须加在氯化钡之后,故答案为:BaCl2、NaOH、Na2CO3(或NaOH、BaCl2、Na2CO3或BaCl2、Na2CO3、NaOH);
(2)钡离子遇到硫酸根离子会生成白色沉淀,因此可以取上层清液少许于试管中,滴加BaCl2溶液,如无沉淀生成,则表明SO42-已沉淀完全;如有沉淀生成,则表明SO42-未沉淀完全,故答案为:静置一段时间后,取少量上层清液再滴加BaCl2溶液,若无沉淀生成,说明SO42-沉淀完全,反之未沉淀完全;
(3)加适量盐酸,可以少引入杂质,并且盐酸与过量NaOH溶液和过量Na2CO3溶液发生反应,离子方程式为:H++OH-═H2O,CO32-+2H+═H2O+CO2↑,从而除掉过量的OH-、CO32-;故答案为:除掉过量的OH-、CO32-;稀盐酸;
(4)粗盐中含有钾离子,所以氯化钠晶体中混有氯化钾,必须进行洗涤,氯化钠不溶于乙醇,可用乙醇冲洗固体表面的氯化钾,这样可以减少晶体的损失,故答案为:75%乙醇。


