题目内容
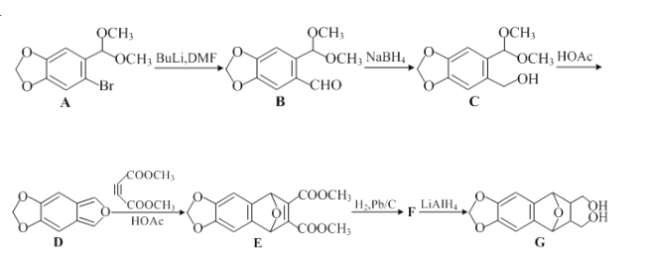
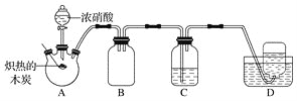
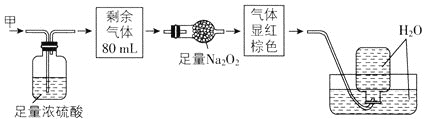
【题目】无色的混合气体甲中可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过如图所示实验处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成可能为( )
A.NO2、NH3、N2B.NH3、NO、CO2
C.NH3、NO2、CO2D.NO、CO2、N2
【答案】B
【解析】
NO2呈红棕色,无色气体甲中一定不存在NO2;100mL气体甲经过足量的浓硫酸,逸出剩余气体80mL,说明气体甲中一定存在能够与浓硫酸反应的NH320mL;剩余80mL气体经过盛有Na2O2的干燥管后气体显红棕色,说明原气体中含有NO及能够与Na2O2反应产生O2的CO2气体,CO2可以和Na2O2反应生成Na2CO3和O2,NO无色,与O2立即反应生成红棕色的NO2,最后经排水法收集,几乎无气体剩余,说明气体甲中无N2(且原气体中NO2和O2按4:1的体积比通入H2O中时可被完全吸收)综上所述可知气体甲的组成可能NH3、NO、CO2,故答案选B。

【题目】根据你所学习的元素周期律和周期表知识回答下列相关问题:
(1)现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 单质是一种淡黄色固体,是黑火药成分之一 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(i)元素Y的氢化物的电子式为____,其水溶液呈碱性的原因是(用电离方程式表示):____;
(ii)元素Z与元素T相比,非金属性较强的是___(填元素符号);
(iii)探寻物质的性质差异性是学习的重要方法之一,T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是___(填化学式)。
(2)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质),把与下面元素有关的性质相符的曲线标号填入相应的空格中:
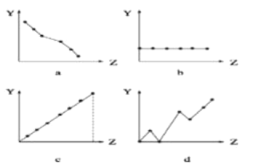
(i)IIA族元素的最外层电子数(填字母)____;
(ii)第三周期元素的最高化合价(填字母)____;
(iii)N3、O2、F、Na、Mg2、Al3的离子半径(填字母)___。
(3)周期表中某些元素化合物的易燃性、毒性变化有一定规律性,例如:
(i)氢化物的易燃性:第二周期___>__>H2O>HF,第三周期SiH4>PH3>___>___(填化学式);
(ii)化合物的毒性:PH3>NH3,H2S___H2O,CS2_CO2(选填“<”、“>”或“=”)。
【题目】下列实验装置、操作正确,且能实现相应实验目的的是:
实验装置 | 实验操作 | 实验目的 | |
A |
| 用标准KMNO4溶液滴定Na2S2O3溶液 | 测定Na2S2O3溶液浓度 |
B |
| 蒸发AlCl3溶液 | 得到AlCl3固体 |
C |
| 逐滴滴加 AgNO3 溶液 | 根据沉淀产生的先后顺序确定Ksp(A gCl)和Ksp(AgI)的大小 |
D |
| 加热 NH4Cl 固体 | 制备 NH3 |
A.AB.BC.CD.D