题目内容
在室温下,向200mL Cu(IO3)2饱和溶液中加入一定浓度100 mL(经酸化)的KI溶液,发生如下反应:
5I-+IO3-+6H+=3I2+3H2O
2Cu2++4I-=2CuI↓+I2
充分反应后,再加入25.0mL 0.234 mol/L KIO3溶液恰好将过量的KI反应掉。再从上述所得混合液中取出25.0 mL,用0.110 mol/L Na2S2O3溶液滴定,发生反应
I2+2S2O32-=2I-+S4O62-
消耗了30.0mL Na2S2O3溶液。溶液体积改变忽略不计。计算:
(1)原饱和溶液中Cu(IO3)2的物质的量浓度;
(2)若Cu(IO3)2饱和溶液的的密度为1.00g/cm3,Cu(IO3)2的溶解度是多少?
5I-+IO3-+6H+=3I2+3H2O
2Cu2++4I-=2CuI↓+I2
充分反应后,再加入25.0mL 0.234 mol/L KIO3溶液恰好将过量的KI反应掉。再从上述所得混合液中取出25.0 mL,用0.110 mol/L Na2S2O3溶液滴定,发生反应
I2+2S2O32-=2I-+S4O62-
消耗了30.0mL Na2S2O3溶液。溶液体积改变忽略不计。计算:
(1)原饱和溶液中Cu(IO3)2的物质的量浓度;
(2)若Cu(IO3)2饱和溶液的的密度为1.00g/cm3,Cu(IO3)2的溶解度是多少?
(1)0.00300 mo1/L
(2)0.124 g
本题考查化计算。(1)混合液中总碘
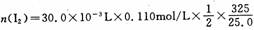
="0.0215" mol
KIO3与KI反应生成的碘n1(I2)=25.0×10-3L×0.234 mol/L×3 ="0.0176" mol
根据上述反应式可知:l mol Cu(IO3)2与KI完全反应可生成6.5 mo1 I2
故:n[Cu(IO3)2]=(0.0215 mol-0.0176 mol)×1÷6.5=0.000600 mo1
C[Cu(IO3)2]=0.000600 mo1÷0.200L=0.00300 mo1/L
(2)Cu(IO3)2溶解度:0.000600 mo1×414g/mol×1÷2="0.124" g

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目

 ;
;