题目内容
取100 g H2O,配成10℃饱和KCl溶液,又取50 g水,加入35.4 g NaNO3,配成10℃ NaNO3溶液。将以上两溶液混合后,10℃时有 种晶体析出,质量是______g,该晶体的化学式为 ,析出该晶体的原因是
一10.6 KNO3 因为溶液中存在K+、Na+、NO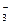 、Cl-四种离子,可以自由组合成KCl、KNO3、NaCl、NaNO3四种物质,在10℃时,S(KNO3)<S(KCl),所以可能有KNO3晶体析出,S(NaCl)<S(NaNO3),所以可能有NaCl晶体析出,经计算知,只析出KNO3晶体。
、Cl-四种离子,可以自由组合成KCl、KNO3、NaCl、NaNO3四种物质,在10℃时,S(KNO3)<S(KCl),所以可能有KNO3晶体析出,S(NaCl)<S(NaNO3),所以可能有NaCl晶体析出,经计算知,只析出KNO3晶体。
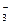 、Cl-四种离子,可以自由组合成KCl、KNO3、NaCl、NaNO3四种物质,在10℃时,S(KNO3)<S(KCl),所以可能有KNO3晶体析出,S(NaCl)<S(NaNO3),所以可能有NaCl晶体析出,经计算知,只析出KNO3晶体。
、Cl-四种离子,可以自由组合成KCl、KNO3、NaCl、NaNO3四种物质,在10℃时,S(KNO3)<S(KCl),所以可能有KNO3晶体析出,S(NaCl)<S(NaNO3),所以可能有NaCl晶体析出,经计算知,只析出KNO3晶体。10℃时,KNO3溶解度最小,所以首先计算是否有KNO3晶体析出。
100 g+50 g="150" g水中能溶解KNO3质量为:
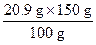 ="31.4" g
="31.4" g
而n(NaNO3)=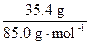 =n(KCl)=
=n(KCl)=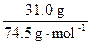 ="0.416" mol
="0.416" mol
则析出KNO3质量为:
101 g·mol-1×0.416 mol-31.4 g="42.0" g-31.4 g="10.6" g
析出KNO3晶体,则不析出KCl晶体和NaNO3晶体。
其次,计算是否有NaCl晶体析出。
150 g水能溶解NaCl质量为:
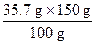 ="53.6" g
="53.6" g
此时溶液中共有NaCl质量为:
58.5 g·mol-1×0.416 mol="24.3" g
可见,不会有NaCl晶体析出。
100 g+50 g="150" g水中能溶解KNO3质量为:
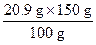 ="31.4" g
="31.4" g而n(NaNO3)=
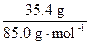 =n(KCl)=
=n(KCl)=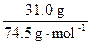 ="0.416" mol
="0.416" mol则析出KNO3质量为:
101 g·mol-1×0.416 mol-31.4 g="42.0" g-31.4 g="10.6" g
析出KNO3晶体,则不析出KCl晶体和NaNO3晶体。
其次,计算是否有NaCl晶体析出。
150 g水能溶解NaCl质量为:
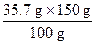 ="53.6" g
="53.6" g此时溶液中共有NaCl质量为:
58.5 g·mol-1×0.416 mol="24.3" g
可见,不会有NaCl晶体析出。

练习册系列答案
相关题目