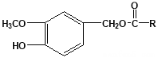
题目内容
【题目】三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:
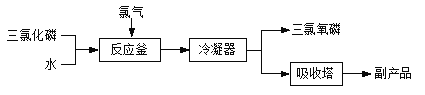
(1)氯化水解法生产三氯氧磷的化学方程式为___________________________。
(2)氯化水解法生产三氯氧磷时,会产生含磷(主要为H3PO3、H3PO4等)废水,已知H3PO3是一种淡黄色晶体,且易溶于水的二元弱酸。
①若用20 mL H3PO3溶液与同浓度的NaOH溶液40mL恰好完全反应,生成的盐为___________________(填“正盐”或“酸式盐”)。
②H3PO3中,P元素的化合价为_______________________。H3PO3可以将溶液中的Ag+还原,从而用于化学镀银,写出该离子方程式_________________________。
③处理废水时,先在其中加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸钙沉淀并回收,加入漂白粉的作用是______________________________________。
④若处理后的废水中c(PO43ˉ)=4×10ˉ7mol·Lˉ1,溶液中c(Ca2+)=________mol·Lˉ1。(已知Ksp[Ca3(PO4)2]=2×10ˉ29)
(3)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·Lˉ1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·Lˉ1 NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10ˉ10,Ksp(AgSCN)=2×10ˉ12
①滴定选用的指示剂是__________(选填字母)。
a.FeCl2b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②实验过程中若未加入硝基苯这项操作,所测Cl元素含量将会_______(填“偏大”、“偏小”或“不变”)。
【答案】(1)PCl3+H2O+Cl2=POCl3+2HCl(2分)
(2)正盐(2分) +3(1分)
H3PO3+2Ag++ H2O = H3PO4+2H+(2分)
将废水中的H3PO3氧化为H3PO4(2分) 5×10-6(2分)
(3)①b(2分) 偏小(2分)
【解析】试题分析:(1)氯化水解法生产三氯氧磷的反应物有PCl3、H2O、Cl2,生成物有POCl3,据原子守恒应该还有HCl生成,反应的方程式为PCl3+H2O+Cl2=POCl3+2HCl。
(2)①若用20 mL H3PO3溶液与同浓度的NaOH溶液40 mL恰好完全反应,即二者的物质的量之比是1:2,由于H3PO3是二元弱酸,因此生成的盐为正盐;
②根据正负价代数和为0可知H3PO3中P元素的化合价为+3价。H3PO3可以将溶液中的Ag+还原,该离子方程式为H3PO3+2Ag++ H2O = H3PO4+2H+。
③处理废水时,先在其中加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸钙沉淀并回收,加入漂白粉的作用是将废水中的H3PO3氧化为H3PO4。
④根据Ksp[Ca3(PO4)2]=[c(Ca2+)]3×c(PO43-)=2×10-29,将c(PO43-)=4×10-7mol·L-1代入计算得c(Ca2+)=5×10-6mol·L-1。
(3)①当滴定达到终点时NH4SCN过量,可以用含有Fe3+的NH4Fe(SO4)2作指示剂,即溶液变为红色,半分钟内不褪色,即可确定滴定终点,答案选b。
②由于AgSCN沉淀的溶解度比AgCl小,可加入硝基苯用力摇动,使AgCl沉淀表面被有机物覆盖,避免在滴加NH4SCN时,将AgCl沉淀转化为AgSCN沉淀;若无此操作,NH4SCN标准液用量偏多,使所测的氯元素的含量偏小。
考点;考查化学综合实验(条件的选择、滴定操作、误差分析、溶解度的计算等)。

 优学名师名题系列答案
优学名师名题系列答案【题目】按如图装置进行实验,下列推断正确的是( )

选项 | Ⅰ中试剂 | Ⅱ中试剂及现象 | 推断 |
A | 氯化铵 | 酚酞溶液不变红色 | 氯化铵稳定 |
B | 硫酸亚铁 | 品红溶液褪色 | FeSO4分解生成FeO和SO2 |
C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾溶液褪色 | 石蜡油发生了化学变化 |
D | 铁粉与水蒸气 | 肥皂水冒泡 | 铁粉与水蒸气发生了反应 |
A. A B. B C. C D. D