��Ŀ����
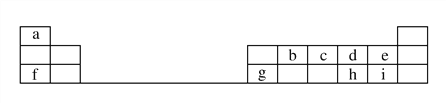
����Ŀ��ij�¶��£���Ӧ2A��g��![]() B��g��+C��g����ƽ�ⳣ��Ϊ1�����ݻ�Ϊ2 L���ܱ������м���A��g����20 sʱ��ø���ֵ����ʵ������±���
B��g��+C��g����ƽ�ⳣ��Ϊ1�����ݻ�Ϊ2 L���ܱ������м���A��g����20 sʱ��ø���ֵ����ʵ������±���
�� �� | A��g�� | B��g�� | C��g�� |
���ʵ���/mol | 1.2 | 0.6 | 0.6 |
����˵����ȷ������ ��
A����Ӧǰ20 s��ƽ������Ϊv��A��=0.6 mol��L-1��s-1
B��20 sʱ������Ӧ���ʵ����淴Ӧ����
C����ƽ��ʱ��A��g����ת����Ϊ100%
D���������¶ȣ�ƽ�ⳣ����Ϊ0.6����Ӧ����H��0
���𰸡�D
��������
���������A����Ӧǰֻ�з�Ӧ��A�����Է�Ӧǰ20 s������A����0.6��2=1.2 mol��v��A��=![]() =0.03 molL-1s-1����A����B��20 sʱ��Q=
=0.03 molL-1s-1����A����B��20 sʱ��Q=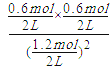 =0.25����KС����δ�ﵽƽ�⣬��B������C�����淴Ӧ��������ȫת������C����D�������¶ȣ�ƽ�ⳣ����С��ƽ��������Ӧ������У�������Ӧ��������D��ȷ����ѡD��
=0.25����KС����δ�ﵽƽ�⣬��B������C�����淴Ӧ��������ȫת������C����D�������¶ȣ�ƽ�ⳣ����С��ƽ��������Ӧ������У�������Ӧ��������D��ȷ����ѡD��

��ϰ��ϵ�д�
�����Ŀ