题目内容
【题目】下列指定反应的离子方程式正确的是
A. 氯气溶于水:Cl2+H2O==2H++Cl-+ClO-
B. 过量HI溶液加入到Fe(NO3)3溶液中:2Fe3++2I-=2Fe2++I2
C. 酸性溶液中KBrO3与KBr反应生成Br2:BrO3-+Br-+6H+=Br2+3H2O
D. NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+ Ba2++OH-=BaCO3↓+H2O
【答案】D
【解析】A. 氯气溶于水,反应的离子方程式为:Cl2+H2O![]() H++Cl-+HClO,选项A错误;B. 过量HI溶液加入到Fe(NO3)3溶液中,反应的离子方程式为:8H++2NO3―+6I-=2NO+4H2O+3I2,选项B错误;C. 酸性溶液中KBrO3与KBr反应生成Br2,反应的离子方程式为:BrO3-+5Br-+6H+= 3Br2+3H2O,选项C错误;D. NaHCO3溶液中加足量Ba(OH)2溶液,反应的离子方程式为:HCO3-+Ba2++OH-=BaCO3↓+H2O,选项D正确。答案选D。
H++Cl-+HClO,选项A错误;B. 过量HI溶液加入到Fe(NO3)3溶液中,反应的离子方程式为:8H++2NO3―+6I-=2NO+4H2O+3I2,选项B错误;C. 酸性溶液中KBrO3与KBr反应生成Br2,反应的离子方程式为:BrO3-+5Br-+6H+= 3Br2+3H2O,选项C错误;D. NaHCO3溶液中加足量Ba(OH)2溶液,反应的离子方程式为:HCO3-+Ba2++OH-=BaCO3↓+H2O,选项D正确。答案选D。

 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案【题目】合成氨是基本无机化工,氨是化肥工业和有机化工的主要原料,也是一种常用的制冷剂.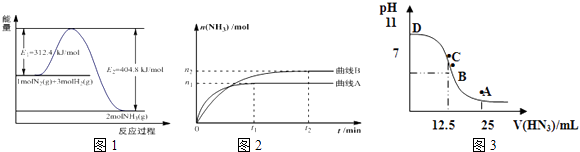
(1)图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图2是合成氨反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图.①下列说法正确的是 .
A.使用催化剂会使E1的数值增大
B.△H=﹣92.4kJmol﹣1
C.为了提高转化率,工业生产中反应的温度越低越好
D.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为 ![]() molL﹣1min﹣1
molL﹣1min﹣1
E.该反应的平衡常数KA<KB
F.图2是不同压强下反应体系中氨的物质的量与反应时间关系图,且PA<PB
②下列能说明该反应达到平衡状态的是
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.v正(N2)=v逆(H2)
C.混合气体的密度保持不变
D.容器内压强保持不变
(2)合成氨技术的创立开辟了人工固氮的重要途径,合成氨反应的平衡常数K值和温度的关系如下:
温度/℃ | 200 | 300 | 400 |
K | 1.0 | 0.86 | 0.5 |
400°C时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3molL﹣1、2molL﹣1、1molL﹣1时,此时刻该反应的v逆(N2)v正(N2) (填“>”、“<”或“=”).
(3)常温下向25mL0.1mol/LNH3H2O 溶液中,逐滴加入 0.2mol/L的HN3溶液,溶液的pH变化曲线如图3所示.A、B、C、D四个点中,水的电离程度最大的是;A点时溶液中各离子浓度由小到大的顺序为 .
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl﹣NH4Cl为电解质溶液制造新型燃料电池.试写出该电池的正极反应式 .