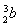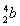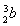题目内容
市场上出售的“热敷袋”的主要成分是铁屑、炭粉、木屑、少量氯化钠和水等。“热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量,使用完后,会发现有大量铁锈存在。
(1)热敷袋是利用________放出热量。
(2)炭粉的主要作用是__________________________________。
(3)加入氯化钠的主要作用是____________________________。
(4)木屑的作用是______________________________________。
(5)有关的电极反应式和化学方程式是____________________________________________。
(1)铁被氧化
(2)与铁屑、NaCl溶液构成原电池,加速铁屑的氧化
(3)NaCl溶于水,形成电解质溶液
(4)使用“热敷袋”时受热均匀
(5)负极:Fe-2e-=Fe2+,正极:O2+2H2O+4e-=4OH-,Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】由铁丝能在氧气中燃烧同时迅速放出大量的热,可推知铁在潮湿的情况下生锈时也会放出热量,只是比燃烧缓慢一些。
日常生活中铁生锈过于缓慢,热量的释放也非常缓慢,难以觉察到。倘若提供适当的条件(如较浓的电解质溶液、导电且不活泼的固体物质)让铁成为原电池的负极材料,铁的氧化速率就会大大加快。木屑的作用是让“热敷袋”产生的热量均匀地向外散失、传递。铁屑、炭粉及NaCl溶液构成原电池,铁作负极,炭粉作正极,将化学能转化为电能,放出热量。

练习册系列答案
相关题目