题目内容
在某一容积为5 L的密闭容器内,加入0.2mol 的CO和0.2mol的H2O(g),在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g),反应放出热量。反应中CO2的浓度随时间变化的情况如下图所示。
CO2(g)+H2(g),反应放出热量。反应中CO2的浓度随时间变化的情况如下图所示。
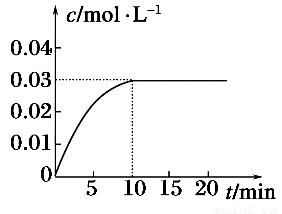
(1)根据图中数据,从反应开始至达到平衡时,CO的化学反应速率为________;反应平衡时c(H2)=________。
(2)判断该反应达到平衡的依据是________(填序号)。
A.CO减少的化学反应速率和CO2减少的化学反应速率相等
B.CO、H2O、CO2、H2的浓度都相等
C.CO、H2O、CO2、H2的浓度都不再发生变化
D.正、逆反应速率都为零
(1)0.003mol·(L·min)-1 0.03mol·L-1
(2)AC
【解析】(1)由图可知第10min时反应达到平衡,所以v(CO)=v(CO2)=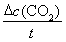 =
= =0.003mol·(L·min)-1,反应时转化的浓度之比=化学方程式的化学计量数之比,所以Δc(H2)=Δc(CO)=0.03mol·L-1。
=0.003mol·(L·min)-1,反应时转化的浓度之比=化学方程式的化学计量数之比,所以Δc(H2)=Δc(CO)=0.03mol·L-1。
(2)达到平衡的标志是各物质的百分含量保持一定,浓度不变,正、逆反应速率相等且不为0。

练习册系列答案
相关题目