题目内容
下列溶液通入过量CO2后,最终溶液中有沉淀析出的是
| A.Na2SO3 | B.BaCl2 | C.Ca(ClO)2 | D.NaAlO2 |
D
解析试题分析:A、碳酸的酸性弱于亚硫酸的酸性,因此CO2通入到亚硫酸钠溶液中不反应,A不正确;B、碳酸的弱于盐酸的酸性,因此CO2与氯化钡溶液不反应,B不正确;C、CO2通入到次氯酸钙溶液中生成次氯酸和碳酸钙白色沉淀,但CO2过量时碳酸钙又溶解生成碳酸氢钙,C不正确;D、CO2通入到偏铝酸钠溶液中生成氢氧化铝白色沉淀和碳酸钠、氢氧化铝不能溶解在碳酸中,因此最终有白色沉淀产生,D正确,答案选D。
考点:考查CO2与盐溶液反应的产物判断

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
硅酸酸性弱于碳酸。下列实验事实能证明此结论的是
| A.CO2溶于水形成碳酸,SiO2难溶于水 |
| B.CO2通入可溶性硅酸盐中析出硅酸沉淀 |
| C.高温下SiO2与碳酸盐反应生成CO2 |
| D.氯化氢通入可溶性碳酸盐溶液中放出气体,通入可溶性硅酸盐溶液中生成沉淀 |
(NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4 =N2↑+6NH3↑+3SO2↑+SO3↑+7H2O
将反应后的混合气体通入BaCl2溶液,产生的沉淀为
| A.BaSO4 | B.BaSO3 | C.BaS | D.BaSO4和BaSO3 |
海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、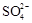 、
、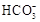 、
、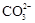 等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示:
等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示: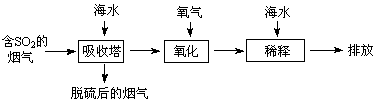
下列说法错误的是
A.海水pH约为8的原因主要是天然海水含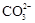 、 、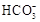 |
B.吸收塔中发生的反应有SO2+H2O H2SO3 H2SO3 |
C.氧化主要是氧气将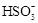 、 、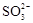 、H2SO3氧化为 、H2SO3氧化为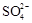 |
D.经稀释“排放”出的废水中,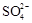 浓度与海水相同 浓度与海水相同 |
下列关于浓硝酸和浓硫酸的叙述中正确的是
| A.常温下均可用铝制容器运输 |
| B.露置在空气中,容器内酸液质量都减小 |
| C.常温下均能与铜较快反应 |
| D.露置在空气中,容器内酸液质量都增大 |
将3.2g铜与过量浓硫酸共热反应,下列叙述中错误的是
| A.铜片溶解,生成物冷却后加水稀释溶液成蓝色 |
| B.生成的气体体积为1.12L |
| C.参加反应的硫酸与被还原的硫酸物质的量之比为2:1 |
| D.该实验中可用Na2CO3溶液处理尾气 |
自来水可用氯气消毒,某学生用这种自来水去配制下列物质溶液,会产生明显的药品变质问题的是
| A.NaNO3 | B.FeCl2 | C.Na2SO4 | D.AlCl3 |
在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是
| A.向氯水中加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在 |
| B.溶液呈浅黄绿色,且有强烈刺激性气味,说明有Cl2分子存在 |
| C.先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明溶液中有Cl-存在 |
| D.加入NaOH溶液,氯水浅黄绿色消失,说明有HClO分子存在 |
如图:A处通入氯气,关闭B阀时,C处湿润红色布条无变化,打开B阀时,C处湿润的红色布条褪色。则D中可以盛放足量的 ( )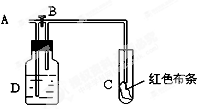
| A.浓硫酸 | B.氢氧化钠溶液 | C.水 | D.饱和食盐水 |