题目内容
【题目】常温下,向Ba(OH)2和NaOH混合溶液中缓慢通入CO2至过量(溶液温度变化忽略不计),生成沉淀物质的量与通入CO2体积的关系如下图所示。下列说法不正确的是
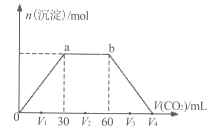
A. b点时溶质为NaHCO3
B. 横坐标轴上V4的值为90
C. V1、V2、V3时,溶液中c(Ba2+)·c(CO32-)相等
D. 原混合物中n[Ba(OH)2]:n(NaOH)=1:2
【答案】D
【解析】
向NaOH和Ba(OH)2的混合溶液中通入CO2,二氧化碳先和氢氧化钡反应生成碳酸钡沉淀,当氢氧化钡消耗完时,继续通入二氧化碳,二氧化碳和氢氧化钠反应生成碳酸钠,当氢氧化钠完全反应后,继续通入二氧化碳,二氧化碳和碳酸钠、水反应生成碳酸氢钠,当碳酸钠完全反应后,继续通入二氧化碳,二氧化碳和和碳酸钡、水反应生成可溶性的碳酸氢钡。
A项、ab段发生反应为2OH-+CO2=CO32-+H2O、CO32-+H2O+CO2=2HCO3-,所以b点溶液中溶质为NaHCO3,故A正确;
B项、发生反应Ba2++2OH-+CO2=BaCO3↓+H2O时消耗30mL的二氧化碳,发生反应NaOH+CO2=NaHCO3时消耗30mL的二氧化碳,发生反应BaCO3+CO2+H2O=Ba2++2HCO3-时消耗30mL的二氧化碳,所以V4为90mL,故B正确;
C项、BaCO3的溶度积Ksp= c(Ba2+)·c(CO32-),温度不变,溶度积不变,故C正确;
D项、发生反应Ba2++2OH-+CO2=BaCO3↓+H2O时消耗30mL的二氧化碳,发生反应NaOH+CO2=NaHCO3时消耗30mL的二氧化碳,发生反应BaCO3+CO2+H2O=Ba2++2HCO3-时消耗30mL的二氧化碳,所以原混合溶液中Ba(OH)2和NaOH的物质的量之比为30:(60-30)=1:1,故D错误。
故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g) ![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
平衡v正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | α1 (SO2) | α2 (SO3) | α3 (SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A. v1<v2,c2< 2c1 B. K1>K3,p2> 2p3
C. v1<v3,α1(SO2) <α3(SO2) D. c2> 2c3,α2(SO3)+α3(SO2)<1