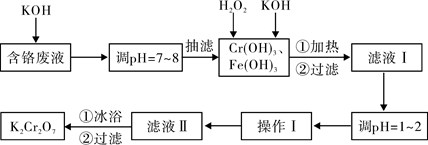
题目内容
(15分)高氯酸铜[Cu(ClO4)2·6H2O]易溶于水,120 ℃开始分解,常用于生产电极和作催化剂等。可由氯化铜通过下列反应制备:2CuCl2+2Na2CO3+H2O===Cu2(OH)2CO3↓+CO2↑+4NaCl;Cu2(OH)2CO3+4HClO4+9H2O===2Cu(ClO4)2·6H2O+CO2↑。HClO4是易挥发的发烟液体,温度高于130 ℃易爆炸。下表列出相应金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1 mol·L-1):
(1) 将CuCl2和Na2CO3用研钵分别研细,加入适量的沸水,搅拌,加热成蓝棕色溶液。静置、冷却、过滤、洗涤得蓝色Cu2(OH)2CO3沉淀。
① 把反应物研细的目的是____________________。
② 检验沉淀是否洗涤干净,应选用试剂是________。
(2) 向Cu2(OH)2CO3沉淀中滴加稍过量的HClO4小心搅拌,适度加热后得到蓝色Cu(ClO4)2溶液同时会产生大量的白雾。
① 大量的白雾的成分是________(填化学式)。
② 适度加热但温度不能过高的原因是____。
(3) 25 ℃时,若调节溶液pH=3,则溶液中的Fe3+的物质的量浓度为________。(已知25 ℃时,Fe(OH)3的Ksp=2.64×10-39)
(4) 某研究小组欲用粗CuCl2固体(含Fe2+)制备纯净的无水氯化铜固体。请补充完整由粗CuCl2固体制备纯净的无水氯化铜固体的实验步骤(可选用的试剂:蒸馏水、稀盐酸、双氧水溶液和氨水):① 将粗CuCl2固体溶于蒸馏水,滴入少量的稀盐酸;② ________,过滤;③ 将滤液________,得到CuCl2·2H2O晶体;④ 将________,得到无水氯化铜固体。
| 金属离子 | 开始沉淀 | 沉淀完全 |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 4.7 | 6.7 |
(1) 将CuCl2和Na2CO3用研钵分别研细,加入适量的沸水,搅拌,加热成蓝棕色溶液。静置、冷却、过滤、洗涤得蓝色Cu2(OH)2CO3沉淀。
① 把反应物研细的目的是____________________。
② 检验沉淀是否洗涤干净,应选用试剂是________。
(2) 向Cu2(OH)2CO3沉淀中滴加稍过量的HClO4小心搅拌,适度加热后得到蓝色Cu(ClO4)2溶液同时会产生大量的白雾。
① 大量的白雾的成分是________(填化学式)。
② 适度加热但温度不能过高的原因是____。
(3) 25 ℃时,若调节溶液pH=3,则溶液中的Fe3+的物质的量浓度为________。(已知25 ℃时,Fe(OH)3的Ksp=2.64×10-39)
(4) 某研究小组欲用粗CuCl2固体(含Fe2+)制备纯净的无水氯化铜固体。请补充完整由粗CuCl2固体制备纯净的无水氯化铜固体的实验步骤(可选用的试剂:蒸馏水、稀盐酸、双氧水溶液和氨水):① 将粗CuCl2固体溶于蒸馏水,滴入少量的稀盐酸;② ________,过滤;③ 将滤液________,得到CuCl2·2H2O晶体;④ 将________,得到无水氯化铜固体。
(1) ① 增大反应物之间的接触面积,使反应速率增大(其他合理答案均可)(2分)
② HNO3和AgNO3溶液(其合理答案均可)(2分)
(2) ① HClO4(1分) ② 防止HClO4、Cu(ClO4)2分解(2分)
(3) 2.64×10-6 mol·L-1(2分)
(4) ② 加入适量双氧水溶液并充分混合,再加入适量氨水调节溶液pH至3.2~4.7(2分)
③ 加热浓缩,冷却结晶,过滤、(冰水)洗涤,干燥(2分)
④ CuCl2·2H2O晶体在HCl气氛中加热至质量不再变化为止(2分)
试题分析:(1)增大反应物之间的接触面积,使反应速率增大;反应生成沉淀和氯化钠,洗涤目的除去沉淀表面的氯化钠等杂质,所以检验洗涤液中是否含有氯离子即可,用HNO3和AgNO3溶液检验;(2)HClO4是易挥发的发烟液体,反应中挥发出形成白雾;产物和反应物HClO4、Cu(ClO4)2均不稳定,反应温度不宜过高防止它们分解;(3)Ksp=c(Fe3+) c3(OH-)=2.64×10-39,c(Fe3+)=2.64×10-6 mol·L-1;(4)该操作时物质的提纯,主要步骤是除去杂质,然后结晶,具体操作为先把亚铁离子氧化为铁离子,然后调节pH形成沉淀除去,再结晶得到CuCl2·2H2O晶体,由于CuCl2水解加热最终得到氧化铜,故需在氯化氢的氛围中加热除去结晶水。
但该题信息中没有给出氯化氢试剂。

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目