题目内容
【题目】设nA代表阿伏伽德罗常数(NA)的数值,下列说法正确的是( )
A.22.4L中含有nA个分子
B.1L0.1mol/LNa2SO4溶液中有0.1个Na+
C.1molH2与1molCl2反应生成nA个HCl分子
D.1molCa变成Ca2+时失去的电子数为2nA
【答案】D
【解析】解:A、气体摩尔体积的考查注意两点:是否为标准状况、是否为气态,该题未说明,故A错;
B、n=CV=1L×0.1mol/L=0.1mol,Na2SO4═2Na++SO42﹣,因此溶液中含有0.2nA个Na+,故B错;
C、根据H2+Cl2 ![]() 2HCl,1molH2与1molCl2恰好反应生成2molHCl,因此该反应有2nA个HCl分子生成.故C错;
2HCl,1molH2与1molCl2恰好反应生成2molHCl,因此该反应有2nA个HCl分子生成.故C错;
D、钙原子的最外层有两个电子,1molCa变成Ca2+时被氧化,失去电子数为2nA,故D对;
故选:D.

 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案【题目】为了改善环境,科学家投入了大量的精力研究碳、氮及其化合物的转化。请回答下列有关问题:
(1)利用N2与H2合成氨是重要的工业反应,下图为反应过程中的能量变化关系。
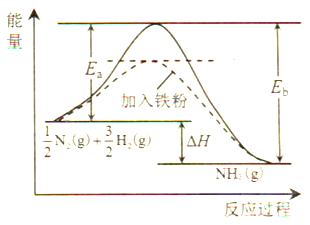
①反应中加入铁粉可以提高反应速率,其原因是____________。
②已知某些化学键键能数据如下表:
化学键 | H-H | N≡N | N-H |
E/(kJ/mol) | 436 | 946 | 391 |
反应![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g)的活化能Ea=254kJ/mol,则反应NH3(g)
NH3(g)的活化能Ea=254kJ/mol,则反应NH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)的活化能Eb=______kJ/mol。
H2(g)的活化能Eb=______kJ/mol。
(2)汽车内燃机工作时会将N2转化为NO,反应式为N2(g)+O2(g) ![]() 2NO(g),该反应在不同温度下的平衡常数K如下表:
2NO(g),该反应在不同温度下的平衡常数K如下表:
温度 | 27℃ | 2000℃ |
K | 3.8×10-31 | 0.1 |
温度为2000℃,某时刻测得反应体系中各物质的浓度分别为c(N2)=0.2mol/L,c(O2)=0.03mol/L,c(NO)=0.03mol/L,此时该反应的速率(v)应满足的关系为_______(填字母序号)。
A.v正>v逆 B.v正=v逆 C.v正<v逆 D.无法确定
(3)工业上可将CO转化成甲醇,反应式为:CO(g)+2H2(g)![]() CH3OH(g)。若在一容积可变的密闭容器中充入1molCO和2molH2进行反应,初始体积为3L,保持压强不变,反应后CO的平衡转化率随温度(T)的变化如右图中曲线所示。
CH3OH(g)。若在一容积可变的密闭容器中充入1molCO和2molH2进行反应,初始体积为3L,保持压强不变,反应后CO的平衡转化率随温度(T)的变化如右图中曲线所示。

①若所加的CO和H2的量以及反应温度均不变,则达到平衡状态A、B时的压强pA____pB(填“>”、“<”或“=”),其原因是___________________。
②若达到化学平衡状态A时,CO的体积分数为25%,此时CO的转化率为_____;平衡常数KA=________。