题目内容
【题目】有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验: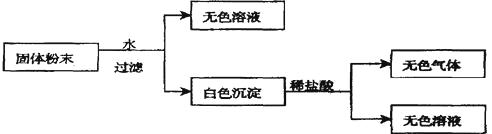
从实验可以判断,该固体粉末中一定不含有 , 它的组成可能是或。发生反应的离子方程式为 。要进一步确定其组成还应进行的实验操作是。
【答案】CuSO4;CaCO3、Na2SO4、KNO3;CaCO3、BaCl2、KNO3;CaCO3+2H+=CO2↑+H2O;向过滤所得溶液中滴加硫酸,若产生白色沉淀说明混合物中含有BaCl2 , 否则含有Na2SO4(有其它合理答案也可以)。
【解析】固体粉末溶于水得无色溶液,说明无CuSO4 , 白色沉淀与盐酸反应产生无色气体和无色溶液说明粉末中含有CaCO3 , 没有BaSO4 , 也说明Na2SO4和BaCl2不能同时存在。因固体粉末由三种物质组成,所以粉末中一定含有KNO3 , 则可能组成为CaCO3、Na2SO4、KNO3或CaCO3、BaCl2、KNO3。要进一步验证Na2SO4或BaCl2是否存在,只须检验溶液中是否有SO42-(或Ba2+)离子就可。

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
【题目】某化学式为AB的离子晶体,已知5r(A2+)=4r(B2-)(各类离子晶体与![]() 关系如下图所示),经测定其密度为
关系如下图所示),经测定其密度为![]() g·cm-3,其摩尔质量为Mg·mol-1,则下列有关该晶体的说法正确的是( )
g·cm-3,其摩尔质量为Mg·mol-1,则下列有关该晶体的说法正确的是( )
r+/r- | 配位数 | 实例 |
0.225~0.414 | 4 | ZnS |
0.414~0.732 | 6 | NaCl |
0.732~1.0 | 8 | CsCl |
>1.0 | 12 | CsF |
A.该晶体结构与ZnS晶体相似
B.该晶体每个晶胞中有2个A2+和B2-
C.该晶体晶胞的边长为 cm
cm
D.A2+离子紧邻的B2-构成的空间结构为立方体
