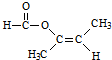题目内容
能正确表示下列化学反应的离子方程式是( )
分析:A.反应实质为氢离子与氢氧根离子生成水;
B.一水合氨在离子反应中保留化学式;
C.反应生成硫酸钡和水;
D.小苏打为碳酸氢钠,与NaOH反应生成碳酸钠和水.
B.一水合氨在离子反应中保留化学式;
C.反应生成硫酸钡和水;
D.小苏打为碳酸氢钠,与NaOH反应生成碳酸钠和水.
解答:解:A.澄清石灰水跟稀硝酸反应的离子反应为OH-+H+=H2O,故A错误;
B.氨水和盐酸反应的离子反应为NH3.H2O+H+=H2O+NH4+,故B错误;
C.稀硫酸与氢氧化钡溶液反应的离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故C正确;
D.小苏打与烧碱溶液反应的离子反应为HCO3-+OH-=CO32-+H2O,故D错误;
故选C.
B.氨水和盐酸反应的离子反应为NH3.H2O+H+=H2O+NH4+,故B错误;
C.稀硫酸与氢氧化钡溶液反应的离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故C正确;
D.小苏打与烧碱溶液反应的离子反应为HCO3-+OH-=CO32-+H2O,故D错误;
故选C.
点评:本题考查离子反应的书写,为高考高频考点,把握发生的化学反应为解答的关键,注意离子反应的书写方法即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
在下列各说法中,正确的是( )
| A、对于2SO2(g)+O2(g)?2SO3(g)△H=-QkJ?mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ | B、热化学方程式中的化学计量数不能用分数表示 | C、Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g)△H<0,该反应的化学能可以转化为电能 | D、△H的大小与热化学方程式的化学计量数无关 |


 (R、R1表示烃基或氢)
(R、R1表示烃基或氢)
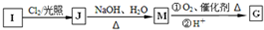
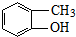
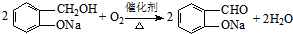
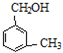 互为同系物
互为同系物