题目内容
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
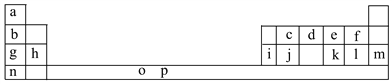
试回答下列问题:
(1)元素p为26号元素,请写出其基态原子电子排布式:___________________。
(2)d与a反应的产物的分子中中心原子的杂化形式为__________,该分子是__________(填“极性”或“非极性”)分子。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:__________________________________________________________。
(4)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是__________________________________________________;
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
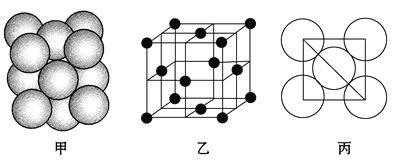
请回答:
①晶胞中i原子的配位数为________,一个晶胞中i原子的数目为________。
【答案】 1s22s22p63s23p63d64s2 sp3 极性 电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量 Mn2+的3d轨道电子排布为半满状态,较稳定 12 4
【解析】(1)元素p为26号元素,为铁元素,其基态原子电子排布式为1s22s22p63s23p63d64s2;(2)a为H,d为N,二者化合生成NH3,分子中N原子含有一对孤对电子,价层电子对数是4,氮原子是sp3杂化。空间构型是三角锥形,所以是极性分子;(3)主要从电子跃迁角度解释,电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量,所以Mg单质在空气中燃烧发出耀眼的白光。(4)o是Mn元素,p是Fe元素,Mn2+的价电子排布为3d5,属于半充满稳定结构,难再失去一个电子,气态Fe2+的电子排布为3d6,失去一个电子后是半充满稳定结构。(5)i为Al原子,以Al原子为中心,每个面的面心处距Al原子最近且相等,共为![]() 12个原子。一个晶胞中Al原子数目为8×1/8+6×1/2=4。
12个原子。一个晶胞中Al原子数目为8×1/8+6×1/2=4。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案