题目内容
将6 mol H2和3 molCO充入容积为0.5 L的密闭容器中,进行如下反应:
2H2(g)+CO(g) CH3OH(g),6秒末时容器内压强为开始时的0.6倍。试计算:(写出计算过程)
CH3OH(g),6秒末时容器内压强为开始时的0.6倍。试计算:(写出计算过程)
(1)H2的反应速率是多少?
(2)CO的转化率为多少?
2H2(g)+CO(g)
 CH3OH(g),6秒末时容器内压强为开始时的0.6倍。试计算:(写出计算过程)
CH3OH(g),6秒末时容器内压强为开始时的0.6倍。试计算:(写出计算过程)(1)H2的反应速率是多少?
(2)CO的转化率为多少?
(1)υ(H2)= 1.2 mol/(L·s)  (2)CO的转化率为60%
(2)CO的转化率为60%
 (2)CO的转化率为60%
(2)CO的转化率为60%试题分析:解:(1)设生成的CH3OH的物质的量为x,则
2H2(g) + CO(g)
 CH3OH(g)
CH3OH(g)开始物质的量(mol) 6 3 0
转化的物质的量(mol) 2x x x
6秒末时各物质的量(mol) 6-2x 3-x x
根据PV=nRT,可以知道P1/P=0.6,即(6-2x+3-x +x)/9=0.6,所以x为1.8mol,所以 2x=3.6mol,即6秒末时容器内氢气的物质的量浓度为c(H2)=3.6/0.5mol/L=7.2mol/L,
所以υ(H2)=7.2/6mol/(L·s)="1.2" mol/(L·s),
(2)CO的转化率=1.8/3*100%=60%
答:H2的反应速率是1.2 mol/(L·s),CO的转化率为60%。
点评:该题考了了化学反应速率的相关计算,是一道常规的计算题,难度不大。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则表示此反应的速率正确的是
4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则表示此反应的速率正确的是 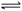 2C(g)+2D(g),在不同情况下测得反应速率,反应最快的是( )
2C(g)+2D(g),在不同情况下测得反应速率,反应最快的是( ) xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求: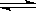 2SO3,当反应进行了10s时,测得SO2的物质的量为0.6mol,求:
2SO3,当反应进行了10s时,测得SO2的物质的量为0.6mol,求: