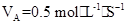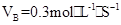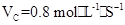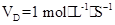题目内容
反应4A(s)+3B(g)=2C(g)+ D(g),经2 min,B的浓度减少了0.6 mol/L。对此反应速率的表示正确的是
A.用A表示的反应速率是0.3 mol·L?1·min?1
B.分别用B、C、D表示的反应速率的比值是3﹕2﹕1
C.在2 min末的反应速率,用B表示是0.3 mol·L?1·s?1
D.B和C的反应速率分别表示2 min内各自的消耗量
A.用A表示的反应速率是0.3 mol·L?1·min?1
B.分别用B、C、D表示的反应速率的比值是3﹕2﹕1
C.在2 min末的反应速率,用B表示是0.3 mol·L?1·s?1
D.B和C的反应速率分别表示2 min内各自的消耗量
B
试题分析:经2 min,B的浓度减少了0.6 mol/L,则用B物质表示的反应速率是0.6 mol/L÷2min=0.3 mol·L?1·min?1。由于反应速率之比是相应的化学计量数之比,所以选项B正确;A中物质A是固体,不能表示反应速率,选项A不正确;反应速率是一段时间内的平均值,而不是瞬时反应速率,C不正确;D中C物质是生成物,应该表示2 min内生成量,选项D不正确,答案选B。
点评:该题是中等难度的试题,也是高考中的常见考点。主要是考查学生对反应速率含义、表示、计算的链接掌握情况,旨在培养学生的能力,提高学生的应试能力和学习积极性。该题的关键是利用好反应速率和化学计量数的关系。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2C(g)+D(g),在某段时间内,以A的浓度变化表示的反应速率为2 mol/(L·s),则以C的浓度变化表示的反应速率为
2C(g)+D(g),在某段时间内,以A的浓度变化表示的反应速率为2 mol/(L·s),则以C的浓度变化表示的反应速率为 2NH3的反应中,在5s中N2由6mol/L减至2mol/L。则NH3的平均反应速率是
2NH3的反应中,在5s中N2由6mol/L减至2mol/L。则NH3的平均反应速率是 ,n=
,n= CH3OH(g),6秒末时容器内压强为开始时的0.6倍。试计算:(写出计算过程)
CH3OH(g),6秒末时容器内压强为开始时的0.6倍。试计算:(写出计算过程) 2AB3的反应,以下反应速率的表示中,速率最快的是( )
2AB3的反应,以下反应速率的表示中,速率最快的是( ) 3C+4D反应中,表示该反应速率最快的是( )
3C+4D反应中,表示该反应速率最快的是( )