��Ŀ����
����Ŀ�������Ǽס��ҡ�����λͬѧ��ȡ���������Ĺ��̣�������벢Э������������ʵ������
(1)ʵ��Ŀ�ģ���ȡ����������
(2)ʵ��ԭ�����ס��ҡ�����λͬѧ����ȡ�Ҵ���������Ũ�����Ϲ��ȵķ�����ȡ������������Ӧ�ķ���ʽΪ______________������Ũ�����������______________��
(3)װ����ƣ��ס��ҡ�����λͬѧ�ֱ������������ʵ��װ�á�
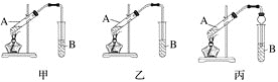
��Ӽס�����λͬѧ��Ƶ�װ����ѡ��һ����Ϊʵ������ȡ����������װ�ã���ѡ���װ����______________(ѡ��ס����ҡ�)����ͬѧ����װ���еIJ����ܸij����θ���ܣ��������������⣬��һ��Ҫ������___________________________��
(4)ʵ�鲽�裺
�ٰ���ѡ���װ�����������Թ����ȼ���2mLŨ���ᣬ��������3mL�Ҵ����ҡ�ȣ���ȴ���ټ���2mL�����
�ڽ��Թ̶ܹ�������̨�ϣ�
�����Թ�B�м��������ı���̼������Һ��
���þƾ��ƶ��Թ�A���ȣ�
�ݵ��۲쵽�Թ�B������������ʱֹͣʵ�顣
����Ϊʵ������д��ڵĴ�����____________________________________________��
(5)�������ۣ�
���Թ�B�б���̼������Һ��������_________________________________________��
�ڴ��Թ�B�з��������������ʵ�������______________________________��
���𰸡� CH3COOH��C2H5OH![]() CH3COOC2H5��H2O ��������ˮ�� �� ��ֹ���� ʵ�鲽�����û���ȼ��װ�õ������ԣ�Ӧ�ȼ����Ҵ����ٻ�������Ũ���� �ܽ��ȥ������Ҵ������������������ܽ�� ��Һ
CH3COOC2H5��H2O ��������ˮ�� �� ��ֹ���� ʵ�鲽�����û���ȼ��װ�õ������ԣ�Ӧ�ȼ����Ҵ����ٻ�������Ũ���� �ܽ��ȥ������Ҵ������������������ܽ�� ��Һ
����������2���Ҵ������ᷢ��������Ӧ��������������H2O����Ӧ�Ļ�ѧ����ʽΪCH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O������Ũ����������ǣ���������ˮ����
CH3COOCH2CH3+H2O������Ũ����������ǣ���������ˮ����
��3���Աȼ�װ�ú���װ�ã���װ���е����ܿ�����B��Һ���£��������������ѡ���װ�����ҡ���ͬѧ����װ���в����ܸij����θ���ܣ��������������⣬��һ��Ҫ�����ǣ���ֹ������
��4��ʵ������д��ڵĴ����У�ʵ�鲽������û���ȼ��װ�õ������ԣ���������Ӧ�ȼ����Ҵ����ٻ�������Ũ������
��5�����Թ�B�б���̼������Һ�����������ܽ��ȥ�Ҵ������ᣬ���������������ܽ�ȡ�
�����Թ�B�з��������������ʵ������ǣ���Һ��
��2���Ҵ������ᷢ��������Ӧ��������������H2O����Ӧ�Ļ�ѧ����ʽΪCH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O������Ũ����������ǣ���������ˮ����
CH3COOCH2CH3+H2O������Ũ����������ǣ���������ˮ����
��3���Աȼ�װ�ú���װ�ã���װ���е����ܿ�����B��Һ���£��������������ѡ���װ�����ҡ���ͬѧ����װ���в����ܸij����θ���ܣ��������������⣬��һ��Ҫ�����ǣ���ֹ������
��4��ʵ������д��ڵĴ����У�ʵ�鲽������û���ȼ��װ�õ������ԣ���������Ӧ�ȼ����Ҵ����ٻ�������Ũ������
��5�����Թ�B�б���̼������Һ�����������ܽ��ȥ�Ҵ������ᣨ��ˮ�����Ҵ���Na2CO3�����ᷴӦ����CH3COONa��H2O��CO2�������������������ܽ�ȡ�
������������������ˮ���ܶȱ�ˮС��Һ�壬�Թ�B�г��ֲַ������Թ�B�з��������������ʵ������ǣ���Һ��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ������ݻ�ѧ����ѧ�ͻ�ѧ����ѧ�ش���������:
I.����������һ����Ҫ�����ʣ��ڿ�ѧ�о�������������Ӧ�ù㷺��
����H2O2��KbrO3��Ӧ�о�˲ʱ��Ӧ����(r)��ԭ��Ϊ������£�KBrO3+3H2O2==KBr+3O2��+3H2O��������ʾ:r=k��cx(KbrO3)��cy(H2O2)������kΪ���ʳ�������290K���ʵ����������:
ʵ���� | 1 | 2 | 3 | 4 |
c(H2O2)/(mol/L) | 1 | 1 | 2 | 4 |
c(KBrO3)/(mol/L) | 0.003 | 0.006 | 0.001 | 0.001 |
R/(mol��L-1��s-1) | 3��10-4 | 6��10-4 | 8��10-4 | 6.4��10-3 |
(1)д��H2O2�ĵ���ʽ____________��H2O2 ���Կ��ɶ�Ԫ���ᣬд����ڶ������뷽��ʽ_________________________________��
(2)���ݱ���������Ϣ��д��˲ʱ��Ӧ���ʱ���ʽr=______(k������λ��Ч����); ���������Ӧ���ʣ��ɲ��õķ�����___________ (��д����)��
II.(3)25�棬101kpaʱ��ϩͪCH2CO(g)�ͼ���CH4��ȼ���ȷֱ�Ϊ:��H=-1025.1kJ/mol����H=-890. 3kJ/mol����Ӧ2CH4(g)+2O2(g)![]() CH2CO(g) +3H2O(l)���Ȼ�ѧ����ʽΪ__________________��
CH2CO(g) +3H2O(l)���Ȼ�ѧ����ʽΪ__________________��
(4)�ں��������С�ͨ��2molCH4��2molO2�������жϷ�Ӧ2CH4(g)+2O2(g)![]() CH2CO(g) +3H2O(l)����ƽ��״̬����_________��
CH2CO(g) +3H2O(l)����ƽ��״̬����_________��
��ϵ��ѹǿ���ֲ��� B.��ϵ�������ܶȱ��ֲ���
C.��λʱ��ÿ����2molCH4��ͬʱ����lmolO2
D.ͨ������ʵ����ķ�Ӧ�һ��ʱ���Ӧ��Ũ��֮�Ȳ���
(5)���ڷ�Ӧ2CH4(g)+2O2(g)![]() CH2CO(g) +3H2O(g)���ں��������£��������ڼ���0.1molCH4��0.1molO2����Ӧ�ﵽƽ��ʱCH2CO�����ʵ����ٷֺ���Ϊ15%����ƽ��ʱn(CH4)=______ mol��
CH2CO(g) +3H2O(g)���ں��������£��������ڼ���0.1molCH4��0.1molO2����Ӧ�ﵽƽ��ʱCH2CO�����ʵ����ٷֺ���Ϊ15%����ƽ��ʱn(CH4)=______ mol��