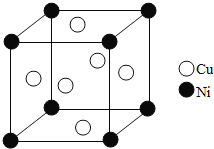
题目内容
【题目】将2.56 g Cu和一定量的浓硝酸反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12 L(标准状况),则反应中消耗HNO3的物质的量为 ( )
A.0.13 molB.1 molC.1.05 molD.0.05 mol
【答案】A
【解析】
Cu与浓硝酸反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,发生3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,根据N元素守恒,消耗硝酸中N的原子转化成硝酸铜中的N原子和氮的氧化物中N原子,据此分析;
Cu与浓硝酸反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,发生3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,消耗硝酸的物质的量为2n[Cu(NO3)2]+n(NO、NO2)=2×![]() +
+![]() =0.13mol,故A正确;
=0.13mol,故A正确;
答案:A。

 阅读快车系列答案
阅读快车系列答案【题目】以下是一些元素的信息,其中有一种元素不在短周期。
元素A | 元素B | 元素C | 元素X | 元素Y |
单质是一种常见金属,与元素X形成黑色和红棕色三种常见化合物 | 基态原子M层p轨道上有5个电子 | 短周期中金属性最强,与X反应能生成两种常见化合物 | 最外层电子数是内层电子数的3倍,能形成双原子阴离子 | 单质为双原子分子,结构中σ键与π数目比为1:2 |
根据上述信息回答下列问题:
(1)写出X3的等电子体_____(写一个即可),基态Y原子核外电子所占据的最高能级的电子云形状为______。
(2)A元素在元素周期表中的___区,基态A原子的未成对电子有___个。
(3)B、C、X的简单离子半径由大到小的顺序为______(填离子符号)。
(4)HX与HY两种共价键中,键的极性较强的是____,键长较长的是____(X、Y用元素符号表示)。
(5)Y与碳元素形成的一种阴离子与Y2是等电子体,请写出该阴离子的电子式___。Y的常见氢化物易溶于水的主要原因是___。
(6)铂丝蘸取化合物CB在酒精灯上灼烧,火焰呈___色,显色原因是___(填序号)。
A.CB受热挥发 B.CB受热分解
C.C离子中电子跃迁 D.B离子中电子跃迁